高美霞吴敏慧纪云鹏蔡莉王泰瑞杨莹梁文飚
【作者单位】:江苏省血液中心;
《中国医药指南》2011年13期
【摘要】:
目的:
研究全血红细胞胞外pH环境对红细胞膜流动性和膜蛋白的影响。
方法:
将全血红细胞悬浮在不同pH值的ACD-B保养液中,分别在4、8和24h,利用荧光探针1,6-二苯基-1,3,5-己三烯(DPH)和SDS-PAGE电泳检测红细胞膜流动性及红细胞膜蛋白;利用透射电镜观察红细胞形态;利用比色法检测红细胞上清中游离血红蛋白(FHb)。
结果:
除了环境pH在6.8的实验组外,其余各组的红细胞的偏振度、微黏度、Band3蛋白、红细胞形态和FHb与正常对照组存在差异性显著。
结论:
全血pH环境可影响红细胞膜流动性和膜蛋白的表达,可对红细胞的功能产生影响。
红细胞悬液由全血制备而来,是目前临床输血中使用多的红细胞类血液制剂。本研究探讨了全血红细胞用于MAP红悬液制备前,其细胞外pH和作用时间对红细胞膜流动性、膜蛋白和形态的影响,为探讨某些特殊情况的血液(如不足量血)制备红细胞悬液的应用潜能提供依据。
1材料与方法
1.1仪器及试剂
HITACHI KY2000型半自动生化分析仪、JEM-1010透射电镜、岛津RF-540型荧光分光光度计、NanoDropND-1000微量紫外可见分光光度计、Bio-Rad电泳仪及QuantityOne分析软件;ACD-B全血保养液为山东威高公司产品,1,6-二苯基-1,3,5-己三烯(diphenyl-hexatriene,DPH)为Sigma公司产品,标准分子量蛋白由MBI公司生产,游离血红蛋白测定试剂由南京生物建成公司提供。
1.2方法
1.2.1红细胞在不同pH值环境的处理
取常规的ACD-B全血保养液,通过缓慢滴加0.1mol/LNaOH制备成不同pH值(pH分别为5.0、5.6、6.2、6.8和7.4)的全血保养液。随机选择6名知情同意的相同血型健康献血者、分别采集5mL肝素抗凝全血;立即将6份同型全血混合以减少个体差异,4℃条件下以等渗PBS(pH7.4)缓冲液,2000g离心10min,洗涤3次,称重压积红细胞,将洗涤红细胞均分6份,1份为对照,5份按红细胞和全血保养液的体积比为4:6的比例,悬浮在不同pH值的ACD-B全血保养液中,分别处理4h、8h和24h后。
1.2.2红细胞膜样品的制备
低渗溶血法制备红细胞膜,实验组和对照组分别取0.5mL压积红细胞,PBS反复洗涤3次,用0.01mol/L tris-Hcl溶血破膜;然后以10000r/min离心15min,反复洗涤3次后的乳白色提取物即为红细胞膜样品,所有操作均在4℃条件下进行,ND-1000微量紫外可见分光光度计测定红细胞膜蛋白浓度。
1.2.3红细胞膜蛋白SDS-PAGE电泳
测定红细胞膜蛋白浓度,取20ug蛋白样品进行SDS-PAGE电泳,考马斯亮蓝染色,QuantityOne软件分析红细胞膜蛋白的组成。
1.2.4红细胞膜流动性的检测
采用文献方法。采用荧光偏振法检测荧光偏振度并计算出红细胞膜的微黏度。用四氢呋喃作溶剂配制2×10-3mol/L的荧光探针DPH储存液,于棕色瓶中4℃保存。临用前用等渗PBS稀释为2×10-6mol/L的工作液,取2mL红细胞膜蛋白(蛋白浓度0.03g/L),加入2mL DPH工作液,37℃温育30min,用荧光分光光度计,测定其荧光偏振度P(激光波长362nm,发射波长432nm激发狭缝10nm,发射狭缝10nm)。利用P与微黏度(η)的定量关系计算出红细胞膜的微黏度。
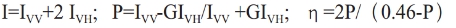
其中I-vv为起偏器与检偏器光轴均在垂直方向时的荧光强度,I-VH为起偏器光轴在垂直方向,检偏器光轴在水平方向时的荧光强度I-vv为二者光轴均在水平方向的荧光强度,I-HV为起偏器光轴在水平方向、检偏器光轴在垂直方向的荧光强度,G为校正因子,G=(I-HV)/(I-HH)。
1.2.5上清FHb浓度的测定
分别在4h、8h和24h检测实验组和对照组上清中FHb浓度。
1.2.6红细胞膜形态的观察
取1mm见方的红细胞团块,用2.5%戊二醛和1%锇酸固定后,经脱干、垫入、分割、染色,置于电镜下观察、拍片记录。
1.2.7统计学处理
数据采用SPSS15.0进行重复测量数据分析。
2结果
2.1不同pH值处理后,红细胞膜荧光偏振度、微黏度和红细胞上清中FHb浓度见图1~3。
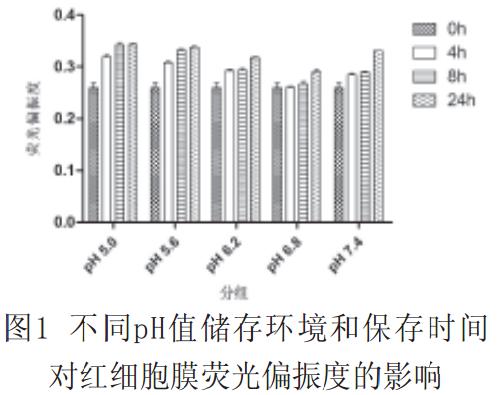
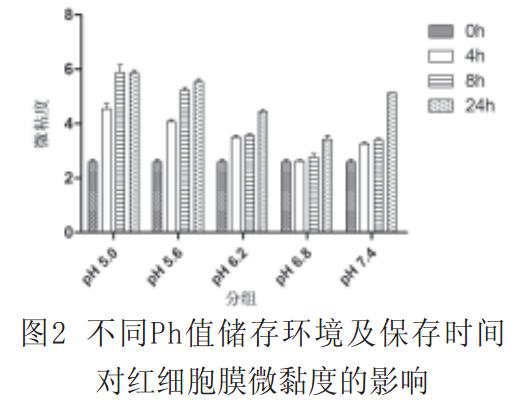
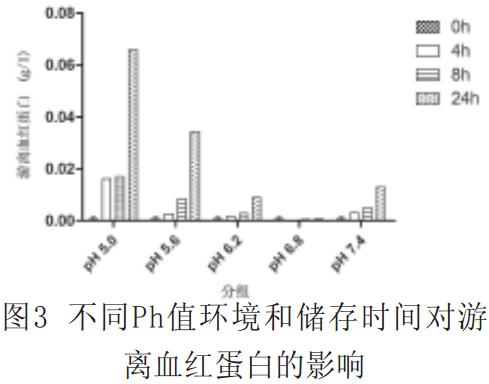
图1中,0h与4h和0h与8h处理组中,除pH=6.8组外,各组的荧光偏振度有统计学意义(P<0.01);0h与24h处理组中,各组的荧光偏振度均有统计学意义(P<0.01);4h与8h处理组中,除pH为5.0和5.6组外各组的荧光偏振度有统计学意义(P<0.01);4h与24h处理组均有统计学意义(P<0.01);8h与24h处理组中除pH为5.0和5.6组外均有统计学意义(P<0.01)。
图2中,0h与4h和0h与8h处理组中,除pH=6.8组外,各组的红细胞膜微黏度均有统计学意义(P<0.01);0h与24h处理组中,各组的红细胞膜微黏度有统计学意义(P<0.01);4h与8h处理组中,除pH为5.0和5.6组外各组的红细胞膜微黏度有统计学意义(P<0.01);4h与24h处理组均有统计学意义(P<0.01);8h与24h处理组中除pH为5.0和5.6组外均有统计学意义(P<0.01)。
图3中,0h与4h、0h与8h、0h与24h、4h与8h、4h与24h和8h与24h处理组中,除pH=6.8组外,各组的游离血红蛋白有统计学意义(P<0.01)。
2.2红细胞膜蛋白SDS-PAGE电泳分析
见图4。
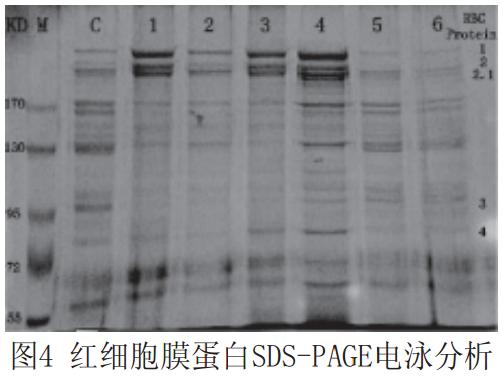
图4中,C为正常对照组,1和2为分别在pH 5.0保养液中处理8h和4h的实验组;3和4为分别在pH 6.2保养液中处理8h和4h的实验组;5和6为分别在pH6.8保养液中处理8h和4h的实验组。
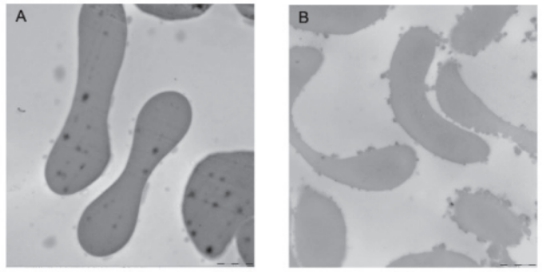
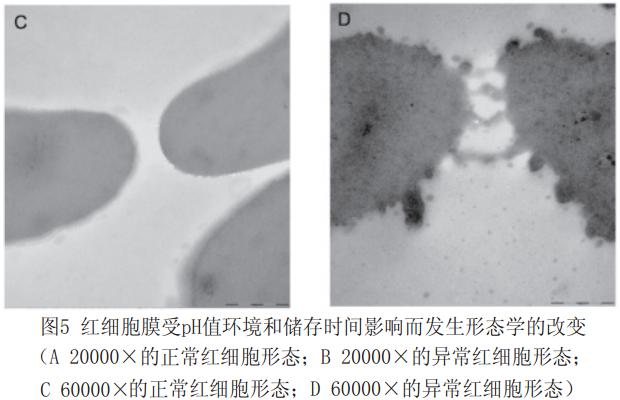
2.3全血红细胞胞外pH环境对细胞膜形态学的影响
显微镜下观察的正常红细胞,表面光滑,边缘整齐。当红细胞胞外pH<6.8后,红细胞膜形态发生改变,大部分表面棘状突起有伸出,并伴随有细胞的聚集,见图5。
3讨论
红细胞周围环境pH值的变化可影响脂双层的稳定性和磷脂在细胞膜上的分布,可改变细胞膜的力学特性、细胞形态大小以及细胞内Hb分子的结构与浓度而影响红细胞的功能和存活。研究证实,红细胞胞外酸碱度与细胞形态结构、膜的变形能力和流动特性以及血红蛋白的携氧能力相互密切关联;Gedde报道红细胞在胞外pH值低于6.3时,红细胞膜曲率为负数,可对胞膜的力学特性及细胞形态产生影响。DPH被认为是一种比较敏感的荧光探针,通过测定反映膜脂区域微黏度的荧光偏振度,可了解膜脂的流动性。我们利用DPH研究了不同pH值保养液和储存时间对红细胞荧光偏振度的影响,实验结果表明,尽管没有任何标本发生肉眼可见的溶血,但pH在5.0~5.6范围内,红细胞的偏振度和微黏度显著上升,流动性变小;红细胞分别在pH6.2~pH7.4的保养液中,其偏振度和微黏度的变化基本相同;只有在pH6.8的保养液中,红细胞才具有与正常对照组相同的偏振度和微黏度以及较好的流动性。
红细胞正常形态的维持依赖于细胞膜及膜骨架的支持,因此细胞形态可以反映细胞膜的结构和稳定性的变化。当红细胞经不同pH值环境和储存时间处理后,部分红细胞发生棘突和形态改变,聚集程度增加,而膜上的自聚集作用可能导致膜融合和形成非专一性离子通道,从而破坏细胞膜结构。另外,红细胞膜流动性的降低,也可造成细胞膜的损害甚至溶血。红细胞在不同pH值保养液中的储存时间对其微黏度和流动性的影响是显著的,通过研究与红细胞膜的弹性特性相关的内在性膜蛋白Band3的表达,我们发现在低于pH6.8的储存环境中,Band3的表达量随着环境pH的降低和储存时间的延长而显著减少;而在pH 6.8的保养液中,Band3在4h内的表达量与正常对照组基本相同。Band3为多次跨膜蛋白,具有阴离子转运功能,Band3和血型糖蛋白分别通过Band 2.1和Band4.1与收缩蛋白结合,使骨架网络附着于膜脂双层上形成膜骨架,低pH环境和保存时间的延长,导致Band3蛋白数量减少或被氧化、降解,与其他蛋白或自身交联、构型改变,骨架蛋白失去与膜内表面的连接,红细胞膜上的脂蛋白及脂质逐渐丧失,使红细胞膜的微黏度升高,膜流动性降低,红细胞逐渐变形,脆性增加。因此,初步的研究结果表明,尽早将红细胞从异常pH环境中分离出来,对于保证红细胞的结构和功能是非常必要的。
目前国内外采供血机构普遍使用ACD(pH 5.03),CPD(pH5.60)和CPDA(pH 5.60)保养液采集全血,由于不足量血的红细胞与保养液的比例失调,导致红细胞的胞外pH值低于正常标准,进而影响红细胞的能量代谢和生理功能。本研究的意义在于为进一步探讨不足量血红细胞的百分比含量以及全血分离时间与红细胞悬液质量的关系,为不足量血潜在的综合利用提供依据,不仅可进一步节约宝贵的血液资源,也体现了对无偿献血者的尊重,在目前血液供应紧张的情况下,不失为一种开源节流、合理用血的应对策略之一。