王军赵晏
西安交通大学医学院生理学与病理生理学系,西安710061;
河南大学体育学院,河南开封475001
摘要:
肌肉延迟性酸痛(delayed onset muscle soreness,DOMS)是生活中经常遇到的一种现象,由于其发生机制尚不十分清楚,并缺乏可靠的防治措施,一直成为运动医学界的重要话题。本文总结了近年来有关DOMS发生机制方面的研究成果,着重从神经生物学角度来探讨和分析DOMS的产生原因。
关键词:肌肉延迟性酸痛;传入神经纤维;敏化
骨骼肌在作不习惯的收缩运动(尤其是离心练习——即肌肉收缩的同时被拉长)后数小时至24小时会出现疼痛,并且在24~72小时达高峰,7天之后可自动消失。通常把这称为肌肉延迟性酸痛(DOMS)。DOMS的主要特点是对机械刺激产生痛敏,如非伤害性的收缩、拍打、按压等刺激可产生疼痛,但无自发性疼痛。DOMS对运动员的日常训练和比赛以及普通人群尤其中老年人的日常生活都会产生一定影响,虽然从上个世纪初人们已经注意到这个问题,并在随后的几十年中投入了大量的研究,但目前仍然没有有效的防治办法,这主要因为DOMS发生的详细机制还不十分清楚。学者们更多的注意集中在肌肉损伤的机制和特性方面,曾提出过“张力增高学说”、“肌肉痉挛学说”、“代谢失衡学说”以及“机械损伤学说”等。目前倾向于认同机械损伤和炎症浸润所致二次损伤是导致DOMS的主要原因。但对于介导痛敏的神经机制方面研究较少。本文拟就DOMS时引起痛敏的神经传导特点及研究现状做一综述。
一、研究模型介绍
通过利用骨骼肌离心收缩训练来制造肌肉延迟性酸痛的方法有很多种,常采用的途径是器械练习:让目标肌肉群借助于外界重物,进行拉长性的收缩。这种方法的优点是负荷的强度和量比较容易控制,另外它是局部的练习,对全身反应影响不大。缺点是较难应用于动物模型。
还有一种方式是,通过有坡度的跑台来进行下坡跑练习。由于下坡跑时股四头肌(对于人来说)的收缩方式很接近于离心收缩,因此也可以达到预期效果。但该运动是一个全身参与的剧烈活动,对身体多系统都可能造成影响,结果会比较复杂,不过这种方式有利于使用动物来开展研究,以达到人体试验无法完成的部分。有关利用动物下坡跑模拟DOMS的研究有不少,但一直以来缺乏模型成立的系统证明。Urai在2007年过脊髓背角c-Fos蛋白的表达、缩回阈值以及发生时程等方面验证了大鼠下坡跑训练能引起DOMS。关于动物单纯骨骼肌离心收缩制造DOMS的公认模型还不多。近年来有学者提出了一种可以借鉴的方法,在麻醉状态下利用大鼠趾长伸肌被动离心收缩模型制造DOMS,并在此模型基础上进行了相关神经生物学试验。该模型的主要步骤是,使用一对针状电极经皮插入支配趾长伸肌的腓总神经附近,通过设定频率的电刺激引起肌肉收缩,在肌肉收缩的同步,利用线性马达牵拉踝关节使足部背屈以对抗电刺激肌肉收缩并使肌肉被动拉长(见图1)。这样反复重复,可以达到肌肉离心练习的效果。为了说明该方法可以制造出DOMS时的肌肉痛敏,又进行了相关行为学和免疫组化试验。之后得出:离心练习48小时后,大鼠肌肉机械触压缩回阈值明显降低,另外,在给肌肉非伤害性重物施压后,试验组大鼠对应脊髓背角c-Fos蛋白表达也明显高于对照组,证明了肌肉痛敏的存在。为研究DOMS神经机制提供了可靠的动物模型。
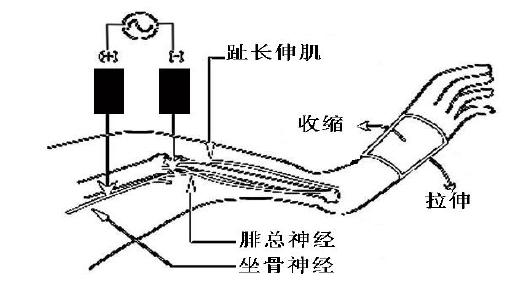
图1大鼠下肢离心收缩练习示意图(引自J Physiol,2005,564:260)
二、DOMS神经机制研究现状
(一)离心收缩对骨骼肌传入细纤维感受器特性的影响
1.自发放电情况
Taguchi的试验结果说明,大鼠在肌肉离心收缩运动后48小时,肌肉Ⅳ类纤维自发放电处于低水平状态,与对照组(无运动)比无明显差异。该放电频率与前人在体或体外记录到的动物肌肉细纤维自发放电情况相似。Ge和Khalsa(2003)曾用大鼠股薄肌标本体外记录C纤维的自发放电情况,Berberich等(1988)曾记录猫在体肌肉C纤维自发放电情况;Kumazawa(1977)记录狗在体肌肉C纤维自发放电情况,结果均表明动物在正常情况下无论在体或离体肌肉C纤维的自发放电频率很低,近乎静息状态。那么Taguchi的结果也与DOMS时肌肉无自发疼痛相符合。但是,值得说明的是Marqueste(2004)用大鼠跑台下坡跑的方法制造骨骼肌离心收缩模型,分离后肢坐骨神经,用在体方法记录后肢肌肉Ⅳ类纤维的放电情况,结果表明:在运动48小时后,Ⅳ类细纤维放电基线频率显著高于对照组(无运动),这种差异在运动后8天消失。由此可见,不同的离心收缩动物模型,对骨骼肌传入细纤维的传导特性影响还是有一定差别的。
2.化学物质、温度刺激
一些学者们认为,大强度的骨骼肌离心练习可使释放入肌纤维间隙的代谢产物(如:乳酸、KCl、H+、ATP、BK)和一些炎症介质增加,这些物质改变了肌肉传入神经感受器的特性,导致DOMS的发生。另外,前人研究发现在肌肉离心练习过程中产生的局部温度要高于向心收缩练习所产生的,是否因为较高的局部温度影响了传入纤维感受器呢?从Taguchi的离体试验表明,在离心收缩练习48小时后,应用乳酸、H+、ATP、BK以及冷热温度刺激,均未发现神经纤维放电的比例或者频率与无收缩练习组比有显著性变化Marqueste的在体试验发现,当大鼠下坡跑练习后48小时,动脉注射乳酸、KCl未能使肌肉Ⅳ型神经纤维放电进一步增加,直至8天后自发放电恢复至无运动组水平。从以上结果表明,肌肉传入神经细纤维对各种化学物质或冷热刺激的反应情况似乎受离心收缩练习的影响不大。
3.机械刺激
DOMS的主要特点是对机械刺激产生痛敏,如非伤害性的收缩、拍打、按压等刺激可产生疼痛,但自发性疼痛不明显。在人体试验表现为对机械刺激的疼痛阈值显著降低,动物试验可表现为肌肉传入神经细纤维受机械刺激兴奋的阈值显著降低。离心收缩练习引起骨骼肌对机械刺激敏感化的原因可能是某种未知的代谢产物或者化学物质改变了一些感受器的特性所致;也有可能是离心收缩练习后引起肌肉产生的僵硬、水肿改变影响了骨骼肌传入神经细纤维对机械刺激的敏感性;另外,如果离心收缩练习引起骨骼肌传入神经细纤维末梢感受器的机械转导通道或离子通道数量增多,也可能会导致机械痛敏。以上均需进一步研究方能证实。
(二)较粗大的有髓传入神经纤维参与DOMS痛敏.
许多研究已表明,在DOMS的发生中有大直径的传入纤维参与作用。Barlas(2000),Weerakkody(2003),Nivan(2001)分别在人体试验中证明了粗大有髓传入纤维机械感受器参与产生了肌肉离心练习所致的疼痛触敏。证据是:阻断粗神经纤维观察DOMS时肌肉机械痛阈增高;局部注射高张生理盐水不能导致DOMS肌肉疼痛度增加,排除DOMS的肌肉痛敏是因为机械感受器的敏化所致;能够使肌梭兴奋的80Hz机械震动可以加重DOMS的疼痛,而一般的局部压力引起的疼痛却可以通过震动得到减轻。
在脊髓背角浅层的中间神经元是痛觉的重要传导通路,20%的这些细胞既对非伤害疼痛传入反应也对伤害性疼痛传入反应。因此,粗大传入纤维(肌梭)很有可能就是通过这类神经元参与疼痛信息过程。我们知道,在正常情况下未损伤肌肉的粗大传入神经纤维是可以通过突触前抑制(门控通道理论)阻止伤害性感受传入的。对正常人施以强压力产生的痛觉,通过振动(引起肌梭兴奋)刺激可以减轻痛感就说明了这一点。那么在DOMS时,粗大传入神经纤维又是如何发挥作用的呢?它们又是如何通过中间神经元的背根反射反过来作用于伤害性疼痛传入纤维引起疼痛敏感的,我们还不得而知。推测,或许是离心收缩练习引起的肌肉损伤触发了足够多的伤害性感受传入,进而启动中枢敏化过程。
(三)DOMS肌肉痛敏分布区域以及牵涉痛
DOMS引起疼痛触敏的中枢机制还不清楚。而牵涉痛作为疼痛的中枢机制的一个表现形式,也常常出现在一些慢性肌肉骨骼系统疼痛的病人中。研究牵涉痛在DOMS影响下的表现情况,既可以帮助揭示DOMS痛敏的中枢机制,也有可能为一些骨骼肌肉慢性疾病提供研究模型。Arendt-Nielsen等人2006年的研究表明了:DOMS影响下,肌肉痛敏主要发生在肌肉组织和肌腱-骨连结部,而纯肌腱部位则不受DOMS影响;另外,做离心收缩练习后,在肌肉远侧端区域,相对于其他部位更容易受到损伤而产生痛敏。在DOMS过程中给肌肉注射高张盐水,引起疼痛的区域面积以及出现牵涉痛的比例均明显高于DOMS前注射所产生的效果。说明DOMS可以易化肌肉在外界刺激时产生疼痛区域扩大以及牵涉痛。该研究结果为探讨DOMS痛敏的中枢机制提供了一个切入点。Taguchi在2007年的研究中观察到DOMS时给予肌肉非伤害性压力,大鼠脊髓背角c-Fos蛋白表达增高的同时对侧背角的表达却受到抑止,这使得DOMS的中枢机制显得更为复杂。因为目前已经报道的可以投射到对侧背角的细传入纤维只有皮肤A高阈值机械感受器,而没有肌肉的Ⅲ、Ⅳ型传入纤维。Farasyn在2007年的文章中谈到肌肉牵涉痛的外周“屏障损伤理论”,即牵涉痛很可能是起源于外周感受器的敏化加上中枢的调制所导致,而非中枢敏化。但是从目前研究结果看,还没有证据表明发生DOMS是由于外周感受器的敏化所致。因为除了机械刺激,无论化学还是冷热温度刺激均未能进一步增加已经被“敏化”的外周感受器生物电的发放或疼痛度增加。
(四)DOMS时骨骼肌损伤及炎症浸润
许多研究中已报道骨骼肌离心收缩可以引起肌纤维结构微损伤,如:Z线、A带、细胞外基质、细胞骨架、肌纤维膜。这种由初始阶段单纯的机械作用导致的损伤,进一步又可触发炎症反应引起二次损伤。近期有不少证据表明DOMS与普通炎症有着相似的循环及组织免疫反应:循环系统中白细胞增多、IL-1、IL-6浓度增多、局部白细胞数量及IL-6的mRNA表达增加。但炎症反应的时程与DOMS时程变化并不一致。DOMS在运动后24~48h出现高峰,而炎症反应的高峰出现在运动后72~96小时。炎症反应可导致前列腺素等物质的释放,因此有可能敏化肌肉伤害性感受器,但是在离心练习前后给予非甾体抗炎药阻断环氧化酶并不能明显减轻DOMS,使用加重炎症反应的药物亦不会加重DOMS,说明这种敏化作用与皮肤伤害性感受器敏化存在药理学差异。但是Marqueste等人用倍他米松预处理大鼠,可以使大鼠在离心运动后48小时肌肉Ⅳ型神经纤维基线放电频率恢复至对照组(无运动组)水平,在此基础上再给予KCl、乳酸等化学刺激,可再次激发起放电频率的增高。说明离心收缩练习引起的炎症因子释放,改变了肌肉Ⅳ型神经纤维的活性。在有关非甾体抗炎药防止DOMS的研究上,不论是临床疗效还是动物试验均还存在不少分歧。对于DOMS时肌肉损伤伴随有炎症浸润的观点,也有学者提出了质疑。Malm和Yu认为:离心损伤是动物实验模型造成的,这种损伤现象很少在人受试者中出现。原因可能是:
(1)动物被动运动和人主动运动形成的生理、心理应激不同从而造成动物骨骼肌细胞损伤较严重。
(2)对动物麻醉注射过程和手术过程均能造成损伤/炎症。
三、小结
DOMS现象做为生活中一种常见的现象,在上个世纪初就已经引起学者们的关注,经过近一个世纪的探索,至今仍然不失为运动医学界的一个热门话题。学者们从各个方面对DOMS的发生、发展机制以及预防治疗措施等进行了研究。但目前还存在很多疑问和矛盾,尤其在治疗上还没有比较稳定和可靠的方法。做为DOMS的主要征兆——肌肉触痛敏感,其必定涉及外周神经末梢感受器以及中枢神经过程的复杂机制。目前,在这方面的研究还相对较少,许多假设还有待进一步去证实。
作者信息:
王军:西安交通大学医学院;06级生理学在读博士生;
工作单位:河南大学体育学院,讲师。
赵晏:教授,博士生导师;西安交通大学医学院生理学与病理生理学系。