马新东周越王瑞元
《成都体育学院学报》2011年02期
【作者单位】:清华大学体育部;北京体育大学;
【摘要】:
综述了近年来细胞外基质蛋白、膜骨架蛋白和肌肉微损伤相关联的研究。对骨架蛋白在运动中的变化进行了由内而外的探讨,重点探讨了细胞外基质蛋白在力的传递和组织结构的保持中可能发挥着的重要作用,阐明了肌细胞骨架蛋白在力的传导过程中存在的可能机理,揭示了细胞外基质蛋白对维持骨骼肌细胞结构稳定方面所起的重要作用。
1骨骼肌细胞骨架蛋白
1.1细胞骨架概述
在肌肉细胞中,细胞骨架和它的结合蛋白组成动力系统,提供各种附着力量,并适应细胞收缩过程中几何形状的改变。细胞骨架在细胞间传递机械和电刺激,它们通过锚定亚细胞结构,如线粒体、高尔基体、细胞核、肌丝等而对细胞的稳定性起重要作用。通过膜相关蛋白,特别是同时与细胞内肌动蛋白(actin)和细胞外层粘连蛋白(laminin)结合的肌细胞增强蛋白,可以起到稳定和机械传递的作用。
1.2骨骼肌细胞质骨架蛋白
1.2.1细胞质骨架蛋白的结构和功能
骨骼肌细胞质骨架可分类为肌节内骨架、肌节外骨架两套骨架细丝系统(肌节内系统由tinin和nebulin组成,肌节外系统主要由desmin组成)。Tinin从Z盘伸展到M带,1983年Lashall等采用免疫电镜初次发现tinin的定位,现在认为tinin是连接Z盘和Myosin之间的蛋白丝,从Z盘至M线,在肌节中具有一定的弹性,并维持Myosin的中间状态。Nebulin在细胞中的定位是1988年发现的,在肌肉放松的状态下nebulin起源于Z盘,延伸至I带,连接于Z盘与Z盘之间,与A带中的actin平行排列,主要作用是保持actin的正常结构。
肌节外细胞骨架主要有中间丝蛋白(intermediatefilaments)组成,它位于肌原纤维周围,连接Z盘、核膜和肌细胞膜之间。研究更多的中间丝蛋白是desmin,其位于肌节Z盘周围,连接相邻的Z盘。
1.2.2骨骼肌细胞质骨架蛋白与运动的相关研究
在大量的肌肉损伤和修复的研究文献中,发现desmin骨架蛋白提供了一个离心收缩后肌肉损伤的形态学指标。Desmin丢失的量与损伤后1~3天收缩力的下降是大致相关的,这表明细胞质骨架蛋白可作为肌肉微损伤后力量下降的解释原因之一。肌节收缩蛋白成分之间的相互作用关系已很明确,在Z盘水平,机械力的整合由desmin中间丝蛋白网和肌节之间发生。肌原纤维Z盘被认为是收缩力的、弹性成分的和细胞骨架的结合点,总之在主动的和被动的力的传递中扮演了一个关键角色。Z盘也被认为是在肌原纤维中更薄弱的部分,因此,发生Z盘流变和Z线模糊的机制可理解为:由于肌肉收缩时肌小节长度可由1%的变化,肌肉收缩时肌节间的运动速度就不一致。根据Katz速度-力量关系曲线,在向心收缩时相邻的肌节间所受到的张力的差异只有1~2%至大张力,而在离心收缩时的差异可达50%,甚至超过肌节所能承受的至大张力值。离心收缩时这些负荷加在Z盘上,就造成了Z盘流变,Z盘的结构遭到破坏,这或许可以解释为什么离心运动之后肌肉会发生延迟性肌肉酸痛。
1.3骨骼肌细胞膜骨架蛋白
1.3.1细胞膜骨架蛋白的结构和功能
膜蛋白质主要以两种形式同膜脂质相结合:表面蛋白质和结合蛋白质。利用电镜冷冻蚀刻技术可以明确的观察到骨骼肌细胞膜中的蛋白颗粒。
质膜下的表层溶胶中具有细胞骨架成分组成的网络结构,除对质膜有支持作用外,还与维持质膜的功能有关,所以这部分细胞骨架又称为细胞膜骨架。细胞膜骨架位于细胞质膜下约0.2μm厚的溶胶层。
1.3.2骨骼肌细胞膜骨架蛋白与运动的相关研究
Lovering和DeDeyne(2003)用荧光免疫标记抗体的方法研究了离心收缩后骨骼肌细胞膜骨架蛋白(α-actinin、desmin、dystophin、β-spectrin)、完整膜结构蛋白(α-andβ-dystroglycan、sarcoglycan)和细胞外基质蛋白(laminin、fibronectin)的变化。在离心运动引起损伤后,肌纤维之间有明显的dystrophin标记缺失,而肌膜骨架的其它成份受影响很小(β-spectrin)或根本没有受影响(α-andβ-dystroglycan),说明dystrophin更易受到攻击,并且dystrophin可能在力量转换中占有重要地位。在DMD(dystrophin缺失)病人的培养骨骼肌细胞中发现了细胞表面形态的变化同时也看到了基膜成分的减少,这些发现说明dystrophin的不足以及DAPS的丢失会导致基膜成分的改变。
Komulainentgi研究了进行拉长收缩对肌纤维微结构的影响。雄性Wistar大鼠的胫骨前肌进行240次用力拉长收缩后,运动后即刻就观察到一些肿胀纤维中就有不再连续的dystophin染色,而在此时其它蛋白(如desmin、actin和fibronectin)的抗体染色则没有改变。6小时后,在所有肿胀纤维中,desmin和dystrophin均已全部缺失,只有部分肿胀纤维表现出actin和fibronectin染色的杂乱。过去认为运动后血清CK等的升高是由于自由基对细胞膜的攻击所致,但又无法很好的解释较少自由基产生的离心运动后血清CK浓度急剧升高现象,对于膜骨架蛋白的认识有助于进一步解释离心收缩后CK、LDH、Mb等肌细胞内容物的漏出。
1.4骨骼肌细胞外基质(ECM)
1.4.1细胞外基质概述
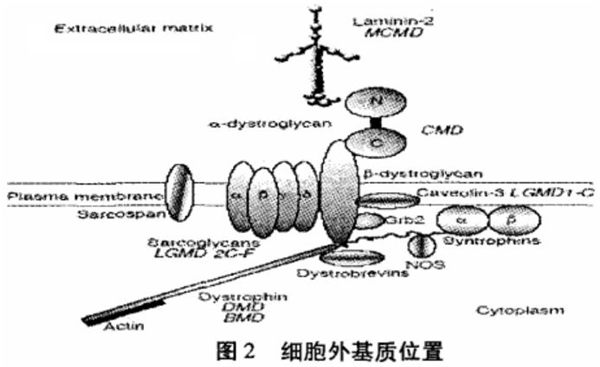
图中英文释义如下:ExtracellularMatrix:细胞外基质;Laminin:层粘连蛋白;
a-Dystroglyean:a型肌营养不良(蛋白)聚糖;B-Dystroglycan:B型肌营养不良(蛋白)聚糖;
Dystrophin:肌养蛋白;Plasma membrane:细胞质膜;Cytoplasm:细胞;
Sarcoglycan:肌聚(蛋白)多糖;Dystrobrevins:抗肌萎缩蛋白;Caveolin:小窝蛋白;
Syntrophins:互生蛋白;Sarcospan:肌长蛋白
细胞外基质(ECM)由基膜(basement membrane或basal lamina)和间质结缔组织组成。基膜把细胞与其下方的结缔组织隔开,基膜不单是起滤筛作用,除此之外它还有许多重要功能,如决定细胞的极性、影响细胞代谢、在细胞质膜附近组织蛋白质结构、诱导细胞分化、引导细胞迁移以及组织再生,在受伤组织再生过程中,基膜发挥了重要作用,只要基膜存在,即可为再生细胞提供支架,让他们沿其迁移。
ECM决定组织的形态和结构,ECM不同成分之间相互作用形成立体骨架结构,对细胞起着支持作用。通过ECM成分与细胞的粘附作用连接细胞。细胞只有通过ECM连接才构成组织。ECM决定组织的牵张强度,组织的牵张强度是指组织破裂时所需要的单位面积的张力。决定正常组织和伤口张力强度的主要ECM成分是胶元。但张力强度并不仅仅取决于胶元的含量,而且与胶元纤维的正常有序结构和合适的纤维素直径有关。ECM还在决定组织的弹性以及创面收缩和维持组织的内环境方面有重要的作用。此外,ECM在储存肽类生长因子,使其不被降解和失活,起贮存库的作用,能结合细胞因子的ECM成分主要是PGS分子。
1.4.2 Laminin-2的结构功能研究
层粘连蛋白(laminin,LN)是基膜的成分并且是主要功能性成分,LN分子由三条肽链借二硫键交联成不对称的十字形分子,分子量巨大,约850KDa,还原后产生一条重链(a链)及两条轻链(B,r链)。
laminin-2被认为是在肌膜和胶元纤维之间起到力的传递作用的细胞外基质蛋白,laminin-2的功能是在细胞间的连接中为胶元和跨膜蛋白的连接起到连接通道作用,前一条连接途径是laminin-2和DGC复合物中的α-dystroglyean捆绑,第二条连接途径是laminin-2和整连蛋白(integrln)复合物中的α7β1-integrin捆绑,这些连接通道使胶元(Collagen)和肌细胞通过层粘连蛋白(laminin-2)相互作用,laminin-2的缺失会使这两条连接途径都瓦解,因此胶元和跨膜蛋白的连接作用也会失去。
近期,膜上Alpha-DG的丢失被观察到,尽管在这之前的研究都表明强调DG和DGC在MCMD显型上都保持不变。MCMD的分子情况是比较复杂的,在MCMD病人肌肉肌膜上发现Alpha-DG是显著下降的,尽管跨膜的beta-DG始终出现,但他的表达水平比正常情况都要高,在转基因大鼠实验中显示,Alpha-DG通过和细胞外基质的捆绑伴侣相互作用而表现得更加稳定,肌肉小型agrin的过度表达laminin和Alpha-DG的捆绑位置能够减轻肌肉营养不良的症状,这个实验显示DG和细胞外基质捆绑物质的相互作用可以作为新的手段治疗肌营养不良。
在MCMD病人和dyw大鼠上发现肌营养不良的分子方面,通过不同laminin变构体不同的生化行为,实际上,Alpha-DG和laminin之间的捆绑不是由heparin所限制的,heparin在很大程度上限制了Alpha-DG和其他laminin异构体的相互作用。在dyw大鼠上发现,laminin-2的缺失会影响其他laminin蛋白的表达,主要是laminin-4的表达,而laminin-4和Alpha-DG的相互作用被heparin所强烈限制,因为heparin和heparan sulfate proteoglycan充足表达的生物活动一样,因此heparan sulfateproteoglycan在MCMD肌肉上的过度表达会很大程度扰乱Alpha-DG和laminin蛋白的连接,这不同的heparin的敏感性可以帮助鉴别特殊调控的Alpha-DG和不同细胞外基质蛋白laminin的相互作用。
1.4.3 CollagenⅣ的结构功能研究
胶元是肌肉连接组织的主要蛋白,只占肌肉瘦体重的1~9%,在骨骼肌上胶元分为四种亚型,分别为CollagenⅠ、CollagenⅢ、CollagenⅣ和CollagenⅤ。组织学观察被称为网状纤维的CollagenⅠ,CollagenⅢ是大胶元在肌外膜(perimysium)上和肌纤维的基膜(basement membrane)相联系,CollagenⅣ纤维就在基膜上,CollagenⅤ是小胶元在肌内膜(endomysium)上,骨骼肌上不同类型的胶元都有自己的结构特性在肌肉功能上起到不同的作用。
CollagenⅣ作为细胞外基质蛋白的一种,在细胞外基质中含量很少,是基膜的框架结构,也是基膜的胶原,在组织中细胞排列和骨骼肌中维持力的稳定性中发挥着重要作用,三股螺旋结构被非螺旋片段隔断24次,非螺旋区为CollagenⅣ提供柔韧性,并易被蛋白酶降解。各CollagenⅣ胶原分子通过C端的球区相互以非共价键结合,而N端则互有一小段重叠并以共价键交联。如此形成三维网络,并为基膜提供造型及刚性。
1.4.4骨骼肌细胞外基质与运动有关的研究现状
Suneal R.Jannapureddy用dy/dy大鼠模型(一种laminin-2缺失鼠模型)研究表明:和对照组相比较,laminin-2缺失大鼠的肌肉收缩力下降,并且伴随着laminin-2的减少,collagenⅣ的含量增加,laminin-2无论在肌纤维横向力和纵向力的传导过程中都起着关键的作用,而且laminin-2的缺失对肌肉的僵硬有影响,对肌肉的横向和纵向的主动力和被动力的改变都有影项。Richard M.Lovering and Patrick G.DeDeyne(2003)研究了离心运动后大鼠骨骼肌laminin-2在即刻、3天、7天、21天时的情况,没有发现变化。
一定形式的慢性负荷练习可以增加胶元的含量,只不过是胶元合成类型和胶元合成的程度不同。这些变化可以改变组织的粘弹性以及机械特性,使组织更易抗拉。Vukko Kovanen等通过免疫荧光染色发现骨骼肌不同类型肌纤维的胶元的含量会因为运动或年龄等因素而发生变化。Kovanen等发现无论是生物化学分析还是组织学分析,慢肌纤维Ⅳ型胶原比快肌纤维胶元含量更丰富,同时免疫荧光染色显示慢肌纤维的基膜(basement membrane)比快肌纤维的基膜要更厚一些。Kovanen等推测快、慢肌纤维的胶元含量不同很有可能会影响到肌肉机械力的特性。Alnaqeeb等通过生物化学和组织学研究发现肌肉胶元的含量随着年龄的增加而增加,在慢肌纤维中胶元的增加是在生长期和年老期,而快肌中的胶元明显的增加是在年老期。而且胶元随着年龄的增加而增加并不是线性的,在成年期胶元含量呈下降趋势。Kovanen和suominen发现对成年大鼠进行耐力训练,训练过的大鼠比未进行过训练的大鼠的胶元含量要高。Koskinen研究了离心运动后大鼠在比目鱼肌和骨四头肌CollagenⅣ含量的变化。发现离心运动后比目鱼肌CollagenⅣ各时相间没有显著性变化。骨四头肌红肌部分CollagenⅣ的含量显著下降,而骨四头肌白肌部分CollagenⅣ的含量7天后有上升的趋势。Koskinen同时发现CollagenⅣ在比目鱼肌含量更丰富,而在骨四头肌白肌部分含量更低。有两种可能的解释,一是在大鼠骨骼肌中Ⅱb型肌纤维是Ⅰ型肌纤维的两倍以上,有可能比目鱼肌比骨四头肌白肌部分的基底膜体积要大,但现在还没有看到关于不同肌纤维类型中基底膜含量不同的研究,这个假设只是推测;还有一种解释就是慢肌纤维的毛细管和肌纤维的比例比快肌要高,因此比目鱼肌CollagenⅣ含量要比骨四头肌高,所对应的就是慢肌的胶元含量要比快肌的要高,这也表明不同肌纤维细胞外基质胶元含量有差异。
2肌力的产生与传导
对于离心收缩来说,力量的传输通路承载了高张力的作用。力的传导是一个细胞产生机械力并且引起细胞内信号传导从而促进细胞生长和存活的重要方面,可以控制多种细胞的形态和结构。细胞外基质(ECM)把身体的组织连接在一起,在力的传递和组织结构的保持中发挥着重要的作用。层粘连蛋白(laminins)和胶元蛋白(collagenⅣ)是细胞外基质中基膜的重要功能性成分,能够和跨膜蛋白连接调整细胞功能并且起到力的传递作用。
laminin-2有可能在肌纤维和胶元的力的传递中发挥着重要的作用,Suneal R.Jannapureddy(2003)研究假设laminin-2缺失会改变骨骼肌的被动僵硬、粘弹性特性以及肌肉收缩力量,利用dy/dy mouse,一种laminin-2缺失鼠模型,来检验肌肉结构的主动和被动变化,当大鼠被麻醉和横隔膜以及后肢二头肌被切离,被动拉长的关系,压力放松曲线,等容收缩特性,Suneal R.Jannapureddy(2003)研究数据显示,laminin-2对肌肉僵硬、肌肉粘弹性、收缩性有作用,其机理可能是laminin-2在肌细胞之间力的传递过程中起作用。马新东研究发现急性运动造成骨骼肌损伤后,基质蛋白CollgenⅣ降解减少,而细胞基质蛋白lamlnin-2不仅没有减少,反而增加,这可能和laminin-2蛋白有代偿功能有关。此外,马新东在随后的研究还发现适应性训练可以增加骨骼肌基质蛋白laminin-2的含量。
3骨骼肌微损伤与肌力的损失
在运动实践中大强度离心运动可以引起延迟性的骨骼肌损伤(微损伤),这种损伤会引起力量的下降等反应,其中包括,骨骼肌内容物泄漏入血,即血清酶、肌内蛋白等的升高。
陈英杰等研究发现,在大强度离心运动后,大鼠的肌肉组织出现一系列的炎症和退行性病变,运动后3小时,深层红肌的肌细胞与筋膜组织连接处已出现胶原细胞核增生现象,部分血管周围已有大量白细胞渗出;运动后24小时和48小时,损伤进一步加重,部分肌细胞变性坏死,肌浆内白细胞浸润。刘显东等的研究也发现在离心运动后48小时肌纤维组织形态学改变更为严重,肌细胞内巨噬细胞明显增多,少数损伤肌纤维的胞浆已被完全清除,肌细胞可见节段性损伤。而且根据肌丝滑动理论,在肌肉收缩过程中,肌球蛋白球头与肌动蛋白不断的再结合。但在离心收缩时,肌动蛋白丝不是向着肌球蛋白丝的中部移动,而是被外力作用向相反的方向移动。因此容易导致肌纤维的机械损伤。FddenJ和Jones D.A分别利用肌肉活检技术从形态学上证实了离心收缩后骨骼肌机械损伤的出现,并指出离心收缩主要有选择的损伤Ⅱ型肌纤维的收缩装置。
肌损伤的重要特征是产生力量能力的立即下降。这种力量的下降已知与几种因素有关:
(1)兴奋收缩解偶联;
(2)产生力量的结构如actin和myosin的破坏和丢失;
(3)力量传送结构如dystrophin、desmin、laminin的破坏和丢失。
骨骼肌的重复的离心收缩可导致等长收缩力的立即下降,这是由于兴奋-收缩解偶联并破坏了力量产生或传递的结构。在起初的力量下降之后,还存在“二次损伤”的现象,即除在运动后即刻观察到损伤外,24~48小时出现的再一次力量下降,或肌组织的病理学改变。一般认为这是炎性细胞介导的病理反应过程,对活动肌肉的牵拉都可以产生各种病理学变化。
4结语
作为骨架蛋白的重要组成部分,细胞外基质蛋白和膜骨架蛋白在维持肌细胞的结构以及力的传导过程中所发挥的作用的研究已经取得了相当重要的成果,但相对的,运动后骨骼肌微损伤的发生及恢复过程中肌细胞的细胞外基质以及膜骨架蛋白在结构、功能方面的变化以及对力的传导过程中的影响的研究还较少,对骨骼肌骨架蛋白ECM以及相关蛋白的研究可以为运动训练中合理的控制负荷强度和负荷量,并在训练后积极有效的进行恢复提供理论依据并且为探讨运动性微损伤的发生机制提供更为全面的理论探讨。