高荣敏马慧萍范小飞贾正平
《医学综述》2013年07期
【作者单位】:兰州军区兰州总医院药剂科全军高原环境损伤防治防治重点实验室;
兰州大学药学院;
【摘要】:
细胞自噬是细胞依赖溶酶体的分解代谢过程,能降解受损蛋白、衰老或损伤的细胞器等细胞结构,可被多种应激所触发。在营养匮乏或组织缺血缺氧等应激条件下,自噬作为相应的代谢过程通过提供代用能源及清除功能异常的细胞器及蛋白质类维持细胞存活。缺血缺氧是细胞自噬激活的重要诱因之一,自噬的适度增强可促进细胞在缺血缺氧等状态下的存活。该文就细胞自噬的分子机制、缺血缺氧状态下自噬调控通路的调节机制及其分子水平检测技术的研究进展予以综述。
细胞自噬是细胞依赖溶酶体的分解代谢过程,据底物进入溶酶体的方式不同,自噬分为巨自噬、微自噬及分子伴侣介导的自噬三种。巨自噬,即由内质网来源的膜包绕待降解物形成自噬体,然后与溶酶体融合并降解其内容物。微自噬指溶酶体或者液泡内膜直接内陷将底物包裹并降解的过程。分子伴侣介导的自噬是指胞质内蛋白先结合到分子伴侣后被转运到溶酶体腔中,然后被溶酶体酶消化的过程,并且由组成型表达的热休克蛋白70作为分子伴侣参与细胞自噬,且需要关键性因子溶酶体缔合性膜蛋白2A(lysosomal-associated membrane protein type 2A,LAMP-2A)。
自噬在临床上的应用愈来愈广,长期以来自噬被认为有助于缺血缺氧状态下细胞的存活。通过自噬标志物发现,哺乳动物细胞缺氧或再灌注缺血时细胞自噬水平增加。近期研究发现,自噬可以维持基础状态下心肌细胞的结构和功能,并在心肌缺血时保护心脏。
1细胞自噬分子机制
正常生理状态下,自噬维持基础水平,但是当出现营养匮乏,氧化应激等状况时,自噬水平会升高。目前将与细胞自噬相关的特异性基因统一命名为autophagy-related gene(Atg)。自噬过程从形态学上划分为三个阶段:自噬诱导阶段、自噬体的形成阶段、自噬体的成熟及其内容物的降解阶段。
1.1自噬诱导阶段
自噬诱导阶段关键性因子是Atg1(酵母中)或其同源物Ulk1(哺乳动物中)复合物、磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)hVPS34-Atg6(Beclin 1)复合物和Atg14(complexⅠ)及其他相关元件。Atg1/Ulk 1复合物受到雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的调控。mTOR有mTORC1和mTORC2两种不同的复合体,其中mTORC1在调控自噬方面起主要作用。在哺乳动物体内,当能量充足时,mTORC1被激活,结合Ulk1-Atg13-FIP200-Atg101复合体,从而抑制自噬。当细胞接受到饥饿信号时,mTORC1失活,与Ulk1-Atg13-FIP200-Atg101蛋白复合体分离,Ulk1被激活,进而导致Atg13、FIF200及Atg101的磷酸化,整个蛋白复合体构象发生改变,从而诱导细胞自噬。
1.2自噬体的形成阶段
自噬过程被诱导后,由mVps34复合物Atg14-Vps15-mVps34启动膜泡的成核反应,然后Atg21和Atg24结合到膜上,形成前自噬体,而后膜泡扩张将底物包绕,形成自噬体。哺乳动物中,Ulk1复合物结合PI3KhVPS34复合物和其产物三磷酸肌醇及蛋白质/脂质复合体PI3-phosphate(PI3P)连同PI3P的效应蛋白导致自噬吞噬体的形成。吞噬泡的延伸及自噬吞噬体的闭合需要Atg9和Atg8(哺乳动物中代表了Atg8蛋白家族:LC3A、LC3B、LC3C、GABARAP、GABARAPL1和GABARAPL2/GATE16),其中Atg9是自噬体形成过程中参与的膜整合蛋白,Atg9的多聚化促进了自噬体膜的形成。LC3家族蛋白的C末端与Atg12-Atg5-Atg16L复合体相结合,该复合体参与自噬体的形成(Atg12先由泛素连接酶活化后与Atg5形成复合体,Atg5-Atg12进而与含有coiled-coil结构域蛋白Atg16结合形成多亚基蛋白复合体)。Atg8蛋白参与吞噬泡膜的延伸、闭合并形成双重膜的自噬吞噬体的过程。
1.3自噬体的成熟及其内容物的降解阶段
自噬体和溶酶体融合后,自噬体内包裹的核糖体、蛋白质聚集体、线粒体等成分将被溶酶体内的多种水解酶降解,某些降解后的产物,如氨基酸、脂肪酸等会重新参与到新陈代谢中去。近期研究发现哺乳动物细胞中,分子伴侣介导的自噬中自噬体与溶酶体融合过程需要LAMP-2A这一关键性分子。
2缺血缺氧状态下自噬调控通路的调节机制
细胞自噬的调节与多个通路多个因子有关,目前研究比较透彻的是Bcl-2蛋白家族、mTOR通路、腺苷酸活化蛋白激酶(AMP-activatedproteinkinase,AMPK)通路和p53通路(图1)。下面将对各个通路及缺血缺氧状态下各通路相关分子机制进行概述。
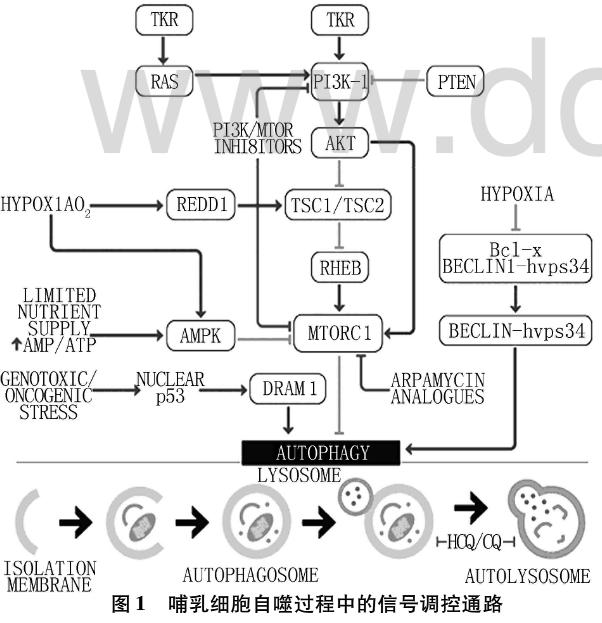
2.1 Bcl-2蛋白家族
Bcl-2蛋白家族是与细胞凋亡相关的基因家族,研究发现该家族与细胞自噬有密切关系,对细胞自噬具双重作用。其中,抑制凋亡的Bcl-2、Bcl-x、Bcl-xL及Mcl-1等蛋白促进自噬,而促凋亡蛋白。Bax、Bad、Bcl-x等却可以促进自噬的发生。研究发现,Beclin-1为自噬调控基因,包含4个结构域:BH3、螺旋-螺旋结构域、进化保守结构域及输出结构域。
Bcl-2通过与Beclin-1的BH3结合,抑制细胞自噬,饥饿处理后JNK1被激活,磷酸化Bcl-2,Bcl-2-Beclin-1复合物解离,游离出Beclin-1,形成Beclin1-hVPS34-PI3K复合体,从而促进自噬。
mVps34、UVRAG及Bif-1等因子则通过与Beclin-1的不同结构域结合并相互作用上调自噬水平。研究发现,mVps34可与Beclin-1的螺旋-螺旋结构域和进化保守结构域结合,促进自噬;UVRAG可与Beclin-1的螺旋—螺旋结构域结合,上调自噬水平;Bif-1则通过UVRAG-Beclin-1复合物来激活mVps34,进而促进自噬。
2.2 mTOR通路
mTOR是一种在进化上较为保守的丝氨酸/苏氨酸蛋白激酶,是磷脂酰肌醇激酶相关蛋白激酶的家族成员,其在调节细胞生长、增殖、凋亡、自噬等方面具有重要作用。
研究发现,mTOR存在两种不同的复合物形式:对雷帕霉素敏感的mTORC1包括mTOR、raptor(regulatory-associatedprotein of roTOR)、mLST8(mammalianortholog of LST8)、PRAS40(proline-richAkt substrate of 40kDa),主要调节细胞生长、细胞凋亡、能量代谢和细胞自噬;对雷帕霉素不敏感的mTORC2包括mTOR、mLST8、rictor(rapamycininsensi tive companion of mTOR)、mSIN1(mitogen-activated protein kinase-associated protein 1),主要与细胞骨架重组和细胞存活有关。其中,mTORC1在调控自噬方面起主要作用。
当细胞缺氧时,可通过REDD1(regulated indevelopment and DNA damage 1)蛋白激活复合型结节性硬化1/2(tuberous sclerosis complex 1/2,TSC 1/2)复合物,继而抑制了RHEB,终抑制mTORC1,激活细胞自噬。TSC1/TSC2异二聚体能够接受Akt等上游激酶信号。酪氨酸激酶受体(tyrosine kinasereceptor,RTK)接受上游生长因子的信号后自体磷酸化激活,进而激活两条关键通路:PI3K-I通路与Ras通路。酪氨酸激酶受体激活PI3K-I通路后,促使磷酸肌醇依赖性蛋白激酶激活Akt,继而抑制下游蛋白复合体TSC1/TSC2,激活mTORC1,抑制细胞自噬。Ras通路激活后,可激活PI3K-Akt-mTORC1通路而抑制自噬,也可通过Raf-1-MEK1/2-ERK1/2通路激活自噬。
当营养缺乏或雷帕霉素刺激时,TORC1活性受抑制,诱导细胞自噬的发生,这一进程需要Atg相关蛋白。Atg1是一种丝氨酸/苏氨酸蛋白激酶,是该阶段关键的蛋白,它通过与Atg13-Atg17复合物的相互作用增强自身酶活性,诱导细胞自噬;mTORC1可通过raptor与ULK1的作用磷酸化ULK1和mAtg13,抑制ULK1的活性,下调细胞自噬。当葡萄糖饥饿时,AMPK激活,mTORC1活性受抑制,后者对ULK1 Ser757位点的磷酸化减弱。AMPK通过增强对ULK1 Ser317位点和Ser777位点的磷酸化,激活ULK1,诱导细胞自噬。
2.3 AMPK通路
AMPK是能量代谢变化的感受器,在能量代谢过程中起重要的调节作用(图2)。当细胞发生葡萄糖饥饿时,ATP/AMP的比例下降,从而激活AMPK。AMPK能磷酸化激活TSC1/2复合物。TSC2具有GTP酶活性,磷酸化激活后的TSC2对小GTP酶Rheb(Ras homolog enriched in brain)起抑制作用,而Rheb是激活mTORC1所必需的,所以通过加强对mTORC1的抑制作用,从而上调细胞自噬。研究发现AMPK可以直接磷酸化raptor,进而抑制mTORC1的活性。Decuypere等发现,胞内游离Ca2+的浓度升高可以激活Ca2+/CaMKKβ和TAK1通路,从而激活AMPK,自噬得以诱导发生。
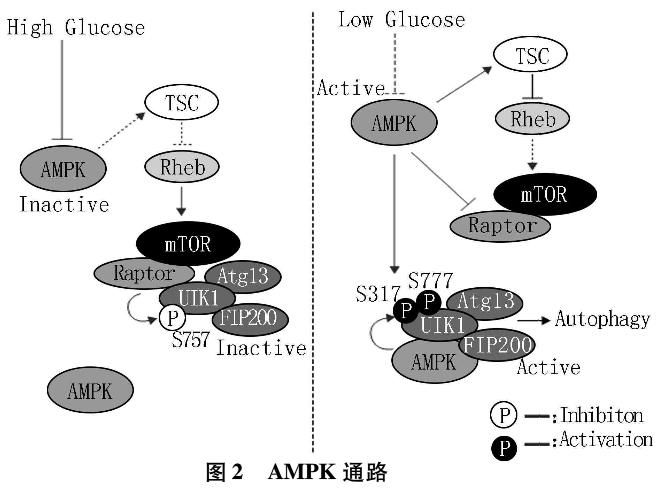
缺血缺氧状态下,细胞发生葡萄糖饥饿,AMPK可通过直接磷酸化ULK1 Ser317位点和Ser777位点激活ULK1,诱导细胞自噬。mTORC1可通过磷酸化ULK1 Ser757位点从而抑制ULK1的活性,激活AMPK,mTORC1受到抑制,故mTORC1磷酸化ULK1Ser757位点的作用减弱,从而激活自噬。研究证明,细胞缺乏营养时,ULK1Sm638位点和Ser758位点先后去磷酸化,进而可以解除AMPK与ULK1间的相互作用,从而激活ULK1,激活细胞自噬。
2.4 p53通路
p53是一种抑癌基因,对自噬的调控具有双重作用。在细胞质中,p53能抑制细胞自噬,但在细胞核中,p53能上调自噬水平。研究发现,死亡相关蛋白激酶也是细胞自噬的重要调节因子,能激活p53,进而激活AMPK,上调自噬。另外,Bcl-2家族促凋亡蛋白Bax、Bad等也能被p53反式激活,使Beclin-1-Bcl-2复合物得以解离,上调细胞自噬。
3缺血缺氧状态下细胞自噬分子水平的检测技术
缺血缺氧是自噬激活的重要诱因之一。在营养匮乏或组织缺血缺氧等应激条件下,自噬作为相适应的代谢过程通过提供代用能源及清除功能异常的细胞器及蛋白质类维持细胞存活。可以通过检测自噬过程所必需的蛋白分子的表达来检测缺血缺氧下细胞白噬的活动水平。
3.1微管相关蛋白1轻链免疫印迹染色
微管相关蛋白1轻链3(microtubule-associated protein 1light ehain3,LC3)是酵母Atgs的同源体,是自噬体膜上的标志性蛋白质。LC3包括LC3-Ⅰ和LC3-Ⅱ两种存在形式,自噬水平升高时,LC3-Ⅰ表达水平下降,而LC3-Ⅱ表达增强,所以两者的表达比值可作为细胞自噬水平的重要指标,其比值下降提示自噬活性减弱;反之则说明自噬活性增强。可采用免疫印迹和免疫沉淀法检测LC3-Ⅰ和LC3-Ⅱ的表达,而后通过两者的表达比值来检测自噬水平。
3.2 GFP-LC3基因转染
GFP-LC3融合蛋白标志物的表达一度被广泛地用于检测细胞自噬水平。有学者研究出了tfLC3(tandem fluorescent-tagged LC3)、GFP-LC3和RFP-LC3在自噬体和自噬前体共表达,呈黄色,溶酶体和自噬体融合形成自噬溶酶体后,GFP信号消失,而RFP可耐受降解,所以RFP信号仍在(红色),因此可作为自噬溶酶体形成的标志。
3.3 p62-SQSTM1疫印迹染色
p62-SQSTM1通过与泛素化蛋白复合物相互作用,进而参与形成自噬吞噬体,激活自噬。研究发现p62在自噬性溶酶体内会被降解,故p62-SQSTM1免疫印迹常作为检测细胞自噬水平的可靠指标,近来研究表明抑制自噬后,p62的表达增加。
3.4 LAMP-2A免疫染色
分子伴侣介导的自噬需要关键性因子LAMP-2A。研究发现,缺血缺氧等应激状态能显著上调LAMP-2A在mRNA及蛋白的表达水平,因此可以进行LAMP-2A的免疫染色和(或)热休克蛋白70双染色来检测细胞自噬水平。
3.5 Beclin免疫染色
哺乳动物细胞中,Bcl-2家族对自噬的调控也发挥双重作用。Beclin-1是酵母Atg6的同源体,可调控自噬体的生成,故其表达增强可作为自噬水平增强的重要指标。
4展望
细胞自噬作为一种基本的生命现象,与许多人类疾病包括癌症、肌病及神经退行性疾病等密切相关,并且还与病原体清除率及抗原呈递相关。缺血缺氧是细胞自噬激活的重要诱因之一,然而自噬与缺血缺氧后导致的疾病间的关系研究尚处于起步阶段,缺血缺氧后自噬的分子机制、所涉及的调控因子及自噬水平的检测,尚需要进一步的研究,从而有助于发现利用自噬治疗缺血缺氧性相关疾病的新策略。