摘录自《器官纤维化分子病理》
重庆医科大学病理生理学教研室沈宜教授
纤维化(fibrosis)可发生在多种器官,导致器官结构破坏和功能减退,乃至器官衰竭。器官纤维化(organ fibrosis)一直是世界医学的研究热点之一。
重要的器官纤维化有肝纤维化、肾间质纤维化、肾小球硬化、肺纤维化、心肌纤维化和胰腺纤维化等,其它如动脉硬化、皮肤硬化、瘢痕疙瘩、骨髓纤维化和肠纤维化等也是较常见的组织器官纤维化。
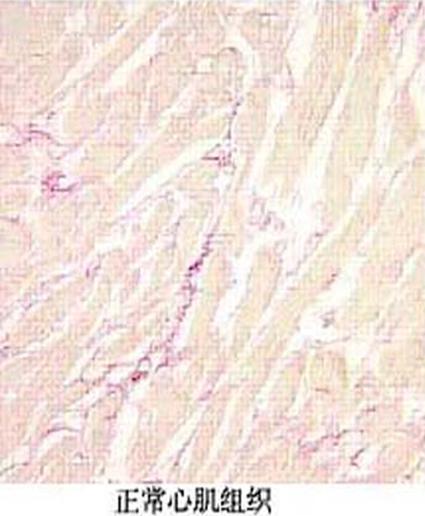
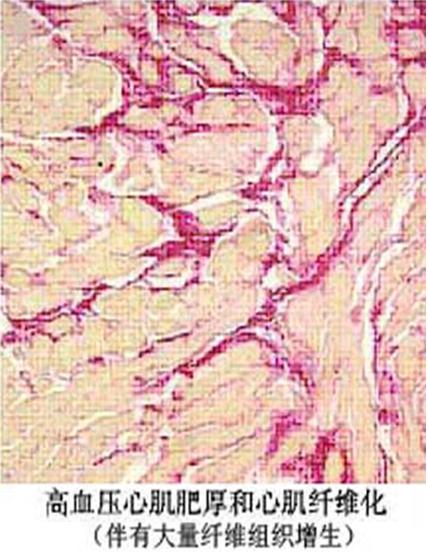
器官纤维化的发生是组织遭受损伤后机体的修复过程,为了恢复组织和器官结构的相对完整性。但是,当这种修复过程过度、过强及“失控”时,过量的细胞外间质(extracellular matrix,ECM)成分沉积在组织内,导致器官纤维化。
一、器官纤维化的概念
是指由于各种慢性刺激因素(炎症、免疫、毒素、缺血及血流动力学改变等)导致器官实质细胞发生坏死,纤维结缔组织,包括细胞成分和细胞外基质(extracellular matrix,ECM)异常增多和过度沉积的病理过程。程度较轻者称为纤维化,重者引起组织结构破坏而发生器官硬化(organ scarring)。
纤维化器官其组织内沉积的纤维结缔组织包括细胞成分和ECM两大部分。
细胞成分:组织的实质细胞、成纤维细胞和单核吞噬细胞等。
ECM:胶原、非胶原糖蛋白、蛋白聚糖和弹性纤维等。
纤维化时ECM沉积并非是简单的“空间占据”,其量和组成成分均发生明显改变,既有原来基质成分的增多,又出现新的成分。肾间质纤维化时,积聚在肾间质的ECM成分,既包括正常肾间质已有的基质蛋白成分(、Ⅲ、Ⅶ型胶原、纤连蛋白和腱蛋白等)的增多,又包括正常时仅存在于肾小管基膜的基质蛋白(Ⅳ型胶原等)的沉积。正常肝组织中有I、Ⅲ、Ⅳ、V和Ⅵ型胶原,其中I和Ⅲ型胶原占胶原总量的90%,以Ⅲ型胶原为主。肝纤维化时,I>Ⅲ>Ⅳ型胶原;发展至肝硬化时,胶原量约增加6倍,I型胶原可达胶原总量的70%。
二、器官纤维化产生的细胞与分子基础
器官纤维化发生机制从过去病理组织学研究发展到细胞和分子水平的研究。虽不同器官纤维化发生机制各有其特点,但基本病理过程相同。
纤维化过程涉及多种细胞、细胞因子和ECM等多个方面。
●各种原因(炎症、免疫、毒物、缺血及血流动力学改变等)引起实质细胞损伤为起点,实质细胞的变性、坏死和炎症,释放细胞炎性介质;
●激活相应的巨噬细胞,释放多种细胞因子、生长因子和血管活性因子等;
●激活静息状态的细胞外基质(ECM)产生细胞,使之转化为肌成纤维细胞(myofi—broblast,MFB),MFB增殖并分泌细胞因子,通过旁分泌方式再作用于巨噬细胞。
●MFB合成大量胶原等ECM成分,同时ECM降解减少,从而导致器官纤维化。
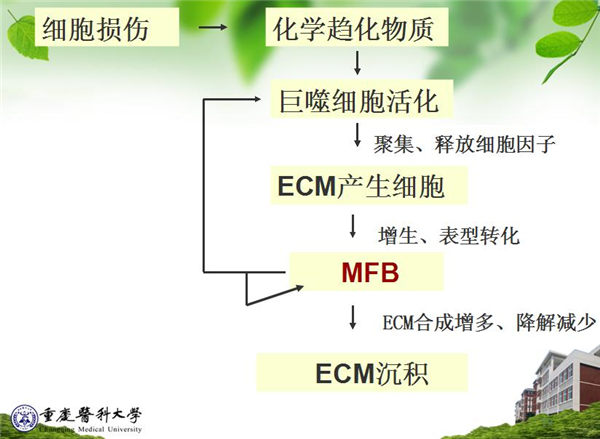
纤维化的形成涉及到:细胞、细胞因子、细胞外基质(ECM)多种因素、多个环节之间相互作用和相互调节的复杂过程,结局是大量ECM沉积。
(一)细胞学基础
1实质细胞
创伤、炎症、免疫、毒物、缺血及血流动力学改变等引起实质细胞损伤为起点,实质细胞的变性、坏死和炎症,释放细胞炎性介质。
2巨噬细胞
受炎性介质作用,循环中单核细胞不断进入局部组织,分化为各脏器所的巨噬细胞,如肺里的尘细胞、结缔组织的巨噬细胞、肝脏的枯否细胞(Kupffer cell)以及炎症部位的巨噬细胞等。巨噬细胞具有特殊的生物学作用,在炎症形成、抗原呈递、组织破坏、创口愈合和瘢痕形成等炎症及组织修复过程中起重要调控作用。
巨噬细胞聚集到损伤的局部:
损伤的开始阶段,局部组织细胞可释放一系列趋化物质,包括细胞间粘附分子-1(ICAM-1)、骨调素(osteopontin)和单核细胞趋化蛋白-1(MCP-1)等,导致巨噬细胞局部浸润,及局部增殖。
活化的巨噬细胞在纤维化中作用:
●使ECM产生细胞增加转化生长因子-β(TGF-β)、血小板源性生长因子(PDGF)、结缔组织生长因子(CTGF)、成纤维细胞生长因子(FGF)的分泌;
●活化的巨噬细胞本身也能产生大量TGF-β、IL-1、IL-6、碱性纤维母细胞生长因子(bFGF)和TNF-α等细胞因子,参与纤维化的进程;
●巨噬细胞自身能产生和分泌I型胶原、FN、硫酸软骨素等ECM成分,直接参与纤维化的形成。
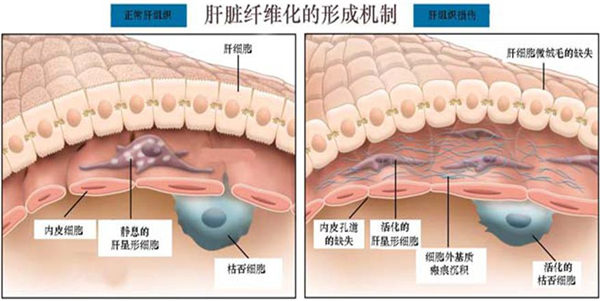
肝细胞慢性损伤刺激活化枯否细胞,活化的枯否细胞通过释放的细胞因子(如TGF-β、IL-1、PDGF和TNF等)的作用再使肝脏星形细胞(HSC)活化。HSC活化是肝纤维化形成的关键步骤,而枯否细胞活化是HSC活化的前导。
3 ECM产生细胞
在纤维化形成过程中,组织内有多种细胞参与ECM的产生,这种细胞被称为ECM产生细胞(ECM-producing cells)。主要是一些间充质细胞(mesenchymal cells)。
在病理情况下,各器官一些实质细胞受到细胞因子刺激,可转变为ECM产生细胞。
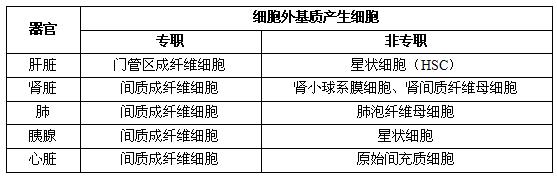
细胞外基质产生细胞的活化
正常时细胞外基质产生细胞处于静息状态。在病理情况下ECM产生细胞形态发生改变,并进入细胞增殖周期,合成分泌细胞因子、大量细胞外基质和产生蛋白降解酶等功能,这一系列变化被称为活化。
ECM产生细胞活化是纤维化形成过程中关键步骤
正常情况下成纤维细胞处于一种低代谢、非激活状态。当受到刺激后,从静息型转化为增殖和过度产生基质的细胞。
ECM产生细胞活化表现:形态改变、功能改变、表型转化。
活化的星形细胞胞体变大、突起形成显著、细胞内粗面内质网及高尔基复合体发达,反映了蛋白合成功能旺盛。胞内脂肪滴的消失,维生素A的含量减少。同时由于细胞内肌动蛋白细丝合成增加,增强了星形细胞的收缩能力。活化的HSC除了增加基质成分的合成外,还能调节ECM的降解,在肝纤维化的进程中起核心作用。
在机体发育的不同阶段或在不同疾病状态下,细胞的形态、结构与功能可发生改变,称为表型转化(phenotype conversion)。
胞浆内含有大量排列成束的微丝、肌动蛋白和粗面内浆网,主要表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),合成细胞外基质的功能明显加强,表明以转化为肌成纤维细胞(MFB myofibroblast)。肌成纤维细胞亦分泌细胞因子、趋化因子、生长因子,通过旁分泌方式再作用于巨噬细胞。
ECM产生细胞的活化是纤维化形成的关键步骤和核心环节。许多因素参与ECM产生细胞活化过程的调节,细胞因子起主要调节作用。
4肌成纤维细胞MFB
体外和体内研究均证明,ECM产生细胞在一定条件下可发生表型转化,转化为表达α-SMA的MFB。MFB兼有平滑肌细胞和纤维母细胞二者的特性,既含有引起收缩的微丝样结构,又能产生胶原等ECM成分,在创伤愈合过程中促进创面收缩和组织硬化。
MFB:主要表达α-SMA(α-smooth’muscle actin),是MFB活跃的标志性抗原。
MFB通过分泌细胞因子、趋化因子、生长因子、ECM和蛋白酶等而发挥生物学作用。虽然在不同器官MFB的来源不同,但有一点是一致的,ECM产生细胞均是MFB的主要来源细胞。肝脏受损后,原来处于静止期的星形细胞(HSC)形态和功能发生很大的变化。尤其是在坏死灶内及周边区,星形细胞失去脂肪滴并增殖,开始产生大量的I型胶原等细胞基质。这一变化称为星形细胞的活化。此时星形细胞高度表达平滑肌α肌动蛋白,具有肌细胞的特征,向肌成纤维细胞(MFB)转化。
一种分化完全的细胞丧失其原有的表型特点而转变为其他类型细胞的现象称为转分化(transdifferentiation)。MBF细胞不仅来自成纤维细胞,也可来自组织实质细胞转分化。在一定条件下肾小管上皮细胞可转分化为肾间质MFB,是近年来肾间质纤维化发生机制的研究热点之一。发生在肾小管的转分化称为上皮细胞—间充质细胞转分化或小管上皮细胞MFB转分化。是细胞表型转化的一种方式。近期研究表明,肾小管上皮细胞转分化为MFB是一种有序的调节过程:上皮细胞形态变化(立方形变为梭形不规则形),细胞间连接减少,丧失与基底膜粘附能力、基膜破坏,α-SMA表达,胶原表达增加,肾小管细胞的迁移和侵袭能力增强等。肾小管上皮细胞转分化为MFB,成为肾间质ECM主要来源。
在组织活动性纤维化区域,肌成纤维化细胞持续存在;当纤维化反应消失时,这些细胞随之明显减少或消失,减少或消失的原因可能是回到其来源细胞或通过细胞凋亡。因此肌成纤维细胞的持续存在或凋亡缺陷可能是纤维化进行性发展的原因。因此,MFB已成为控制纤维化进展的重要细胞。研究MFB的病理表型特征及其关键细胞内信号转导途径和调控规律,对深入认识纤维化发生的分子机制至关重要。
(二)细胞因子的作用
细胞因子(cytokines)是由细胞分泌的、能调节细胞功能的多肽。细胞因子通过自分泌(autocrine)和旁分泌(paracrine)方式发挥其生物学效应。通过与靶细胞表面相应受体相互作用,将生物信号转导至细胞内,启动信号转导的级联(cascade)反应,调控基因表达事件。
参与器官纤维化形成的常见细胞因子有:
转化生长因子-β:TGF-β(transforming growth factor-β);
结缔组织生长因子:CTGF(connective tissue growth factor);
血小板源性生长因子:PDGF(platelet-direvedgrowth actor);
碱性纤维母细胞生长因子:bFGF(basic fibroblastgrowth factor);
表皮生长因子:EGF(epidermal growth factor,);
胰岛素样生长因子-1:IGF-1(insulin-like growth factor,);
IL-1、IL-6、IL-8、TNF-α、IFN-γ等
它们可来自浸润的炎症细胞(中性粒细胞和单核巨噬细胞等),也可来自血小板和组织的固有细胞。这些细胞因子相互制约、相互调控,形成复杂的“细胞因子网络”,共同参与纤维化形成的多种反应过程
细胞因子参与纤维化过程大致可分为3种情况:
①参与局部损伤和炎症反应:TNF-α、IL-1和IL-8等;
②参与组织修复和纤维化的进展:TGF-β、CTGF、PDGF、IGF-1及bFGF等;
③损伤和抑制纤维化的作用:肝细胞生长因子(hepacyte growth factor,HGF)、IFN-r和转化生长因子(TGF-α)等。
纤维化过程中涉及促纤维化细胞因子与抑纤维化细胞因子的相互作用。生理情况下,细胞因子构成网络处于平衡状态。病理情况下这一平衡被打破,促纤维化细胞因子增加,并发生级联效应,而抑纤维化细胞因子活性降低,从而导致ECM过度沉积而形成纤维化。因此,这两类细胞因子之间的平衡在很大程度上决定着纤维化是否发生和严重程度。
1转化生长因子-β(TGF-β)
是属于一组新近发现的调节细胞生长和分化的TGF-β超家族。还包括活化素(activins)、抑制素(inhibins)、和骨形成蛋白(BMPs)。具有广泛的生物学作用,调节细胞生长、分化、凋亡、迁移、黏附、基质形成,以及损伤修复等。在促纤维化作用是细胞因子中非常强的。
TGF-β是由两个分子量为12.5kD的亚基通过二硫键连接而成的同源二聚体,二聚体形式的TGF-β才具有生物活性。TGF-β有5种同分异构体,哺乳动物主要有TGF-β1、TGF-β2和TGF-β3的3种形式,三者的生物学作用基本相似,其中以TGF-β1更重要。新合成的TGF-β是一类由390个氨基酸组成的无活性前体蛋白,必须经蛋白酶切去N-末端的潜活相关肽(1atent-associated peptide)才能被激活。TGF-β的命名是根据能使正常的成纤维细胞的表型发生转化,即在表皮生长因子(EGF)同时存在的条件下,改变成纤维细胞生长特性。TGF-β1在人血小板和哺乳动物骨中含量更高;TGF-β2在猪血小板和哺乳动物骨中含量更高;TGF-β3以间充质起源的细胞产生为主。
TGF-β受体
已知有5种TGF-β受体(I~V型)。
I型和Ⅱ型受体是主要的信号传递受体,I型和Ⅱ型受体是跨膜的丝氨酸/苏氨酸激酶。Ⅲ型受体为跨膜蛋白聚糖,分为膜结合型和游离型,前者能增加TGF-β与Ⅱ型受体的亲和力,而后者则能阻止TGF-β与其受体结合,从而干扰TGF-β的生物学作用。
TGF-β先与Ⅱ型受体结合,再与I型受体结合形成复合物,形成稳定的异源配体-受体复合体,TGF-βR I中的丝氨酸/苏氨酸位点发生磷酸化,即将信号由细胞外传入细胞内发挥生物学作用。TGF-β可通过多个环节和机制导致ECM过度积聚和纤维化形成:
①刺激ECM产生细胞合成大量ECM,如I、Ⅲ、Ⅳ型胶原和非胶原糖蛋白等;
②通过抑制ECM降解酶基质金属蛋白酶(MMPs)、纤溶酶原激活物(PA)的活性;增强这些降解酶的抑制物如金属蛋白酶组织抑制物-1(TIMPs)和纤溶酶原激活物抑制物-1(PAI-1)的活性,从而减少ECM的降解;
③促进ECM产生细胞表达α-SMA,使其活化并发生表型转化,转变为MFB,后者能合成和分泌大量胶原等ECM成分;
④增加ECM受体如整合素的表达,从而促进ECM与细胞间的相互作用。
⑤可与其它细胞因子如PDGF、IL-1和bFGF等协同发挥生物学效应,促进纤维化。
TGF-β诱导ECM产生的信号转导途径目前尚不十分清楚,其基本过程是:
FGF-β配体→膜受体→SMAD蛋白→转录因子→基因表达。
2结缔组织生长因子(connective tissue growth factor,CTGF)
CTGF蛋白是一种富含半胱氨酸的分泌性多肽,分子量为38 KD,属于即刻早期基因家族CNN(Cry61、CTGF、Nov)成员之一。人CTGF是含349个氨基酸的多肽,基因位于染色体6q23.1,由5个外显子与4个内含子组成。CTGF氨基酸序列中有38个保守的半胱氨酸残基,这些半胱氨酸残基参与二硫键的形成。CTGF能促使Ⅰ型、Ⅲ型胶原、纤连蛋白等细胞外基质的合成,在创伤愈合、器官纤维化发生中已观察到结缔组织生长因子的过度表达。CTGF可能在与TGF-β其下游起作用:
TGF-β的生物学作用部分是由CTGF介导的,在CTGF的启动子145至157核苷酸序列中存在TGF-β应答元件,在该区域定点突变后,TGF-β将完全失去对CTGF的调控作用。
研究发现,TGF-β刺激血管平滑肌细胞,其CTGF mRNA水平上调20倍;TGF-β在纤维化早期一过性表达,而纤维化持续发展依赖CTGF维持;在无TGF-β情况下CTGF可直接刺激细胞向MFB转化。说明CTGF作为TGF-β下游分子,是TGF-β促进纤维化中重要的中介分子。近年研究证明,在CTGF启动子中有SMAD结合位点,TGF-β通过SMAD途径诱导CTGF转录。
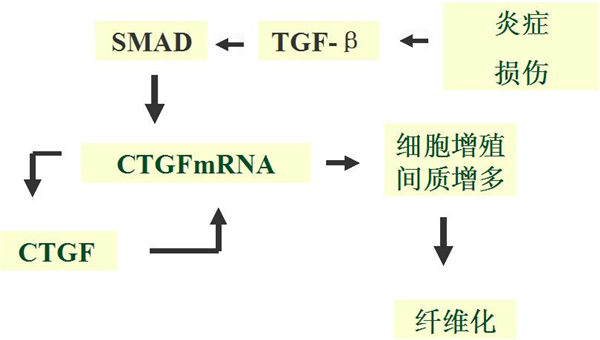
CTGF在纤维化形成中的作用:
①促进细胞增殖、粘附、迁移、整合素表达;
②促使Ⅰ、Ⅲ型胶原和FN等ECM的合成;
③在创伤愈合、皮肤、肾脏、肝脏、心脏、肺脏和胰腺纤维化以及粥样硬化的动脉,均观察到呈高表达的CTGF,表明CTGF是致使纤维化持续发展的共同和关键因子。
TGF-β生物学效应具有“双面刃”作用:
①正常表达时能抑制炎症和细胞增生,对内皮素、一氧化氮合酶及三磷酸肌醇酯受体也有重要影响,此为其正面效应;
②过度表达时则可引起病理性改变,如引起ECM积聚和组织器官纤维化,即负面效应。因此,抑制TGF-β的负面效应可能限制TGF-β的正面效应。如敲除TGF-β1基因的小鼠,因失去对炎症的抑制而在出生后很快死于全身性感染。
研究发现:CTGF是TGF-β的下游效应介质,但在炎症和免疫反应调节中不涉及CTGF。因此,CTGF仅介导TGF-β促ECM合成的负面效应。对于TGF-β来说,阻断CTGF的抗纤维化作用应该更有效和安全。正常情况下CTGF表达水平很低,主要在间质细胞表达。阻断CTGF不会出现阻断TGF-β后可能产生的不利临床反应。近期开发CTGF的中和抗体和反义核酸,已证实能阻断TGF-β1刺激的胶原合成。因此CTGF可能成为防治器官纤维化提供一个更特异更安全的新治疗靶。
CTGF产生的主要抑制剂有cAMP、forskolin、霍乱毒素、前列腺素E2、前列环素、TNF-α和肝素等。这些物质均作用在转录水平,减少CTGF mRNA的表达。前列腺素E2、forskolin和霍乱毒素通过增加腺苷酸环化酶活性,增加cAMP,抑制CTGF产生。CTGF作为TGF/SMADs途径的下游介质参与病理性纤维化进程。阻断CTGF的产生及其促纤维化效应可能为今后病理性纤维化的治疗提供了一个新靶点。
3其它致纤维化细胞因子
(1)TNF
TNF为多功能性多肽,在炎症、免疫和肿瘤发生过程中具有重要调节作用。有TNF-α和TNF-β两种。TNF-α分子量17 kD。TNF-α有1型和2型两种受体,TNF-α与其受体相结合可激活许多信号转导途径,由此引起多种转录因子、细胞因子、生长因子、受体、细胞粘附分子、炎症介质及急性期蛋白(acute phase protein)等的表达。
TNF-α具有聚集炎症细胞的作用,对单核细胞趋化蛋白-1(MCP-1)、细胞间粘附分子-1(ICAM-1)和血管细胞粘附分子-1(VCAM-1)等具有上调作用,从而促使巨噬细胞等炎症细胞迁移至受累部位;TNF-α能刺激纤维母细胞增殖,促进胶原合成,在肝脏可促进HSC增殖并向MFB转化;在肝坏死灶及其周围,激活的枯否氏细胞和大量浸润的巨噬细胞,及受损的肝细胞等均可产生很多细胞因子,如TNFα、IL-6和其他活性物质,可使静止期星形细胞表达转化生长因子受体、血小板源生长因子(PDGF)受体的功能亢进,从而使星形细胞对细胞因子的刺激具有了反应性。
(2)血小板源性生长因子(PDGF)
PDGF可使处于静止期的G0细胞进入Gl期及Sl期,是促使ECM产生细胞DNA合成和细胞增殖十分有效的有丝分裂原。PDGF-BB能促使纤维母细胞转化为MFB,并可介导MFB表达α1(Ⅲ)胶原基因。外源性PDGF直接加入到纤维母细胞培养中,能显著增强其增殖,这种作用可被抗PDGF抗体所阻断。在肝脏受损时巨噬细胞、血小板、浸润的炎细胞、肝星状细胞(HSC)均可以合成和分泌PDGF,以自分泌和旁分泌的形式发挥作用,PDGF与其受体结合后,通过RasERK、P13K、钙通道和Na+H+交换等途径进行胞内信号转导,促进HSC增殖和迁移,并诱导HSC合成TGF等细胞因子。
(3)碱性纤维母细胞生长因子(bFGF)
bFGF具有多种生物学功能,是重要的促有丝分裂因子,能促进纤维母细胞的有丝分裂、增殖和分化,是纤维化的启动因子。研究显示,bFGF可刺激潜活性TGF-β释放;bFGF作为纤维母细胞增殖的强诱导剂,能刺激纤维母细胞增殖,并能诱导α-SMA的表达;bFGF还能明显增加I型和Ⅲ型胶原mRNA的表达。在大鼠Heymann肾炎时,bFGF能加剧足细胞的损伤和肾小球硬化,应用抗bFGF抗体治疗有效。
(4)白细胞介素-1(IL-1)
IL-1是单核巨噬细胞分泌合成的一种前炎症细胞因子,分为IL-1α和IL-1β两种亚型,在组织急性损伤中起重要作用。IL-1能诱导其它炎症细胞因子(如IL-6)、趋化因子、粘附分子、急性期蛋白和组织蛋白酶等的合成,对嗜中性粒细胞、巨噬细胞具有趋化和促进释放炎症介质的作用;IL-1能刺激纤维母细胞增殖和产生ECM成分。
(5)激活素
激活素(activin)一早在性腺发现的糖蛋白激素,因能刺激垂体细胞分泌卵泡刺激素而得名,后来发现具有多种生物学功能,属于TGF-β超家族的成员。激活素参与机体炎症反应和组织损伤修复过程,一定水平激活素有助于损伤修复过程的正常进行,但其过量表达可能与器官纤维化形成有关。实验性肝纤维化模型,激活素某些亚基表达水平增高,且可能与TGF-β有协同作用。博莱霉素诱发的小鼠肺纤维化,肺组织激活素A表达增加,激活素A可刺激肺纤维母细胞增殖和转变为MFB。动脉粥样硬化和炎症性肠病等过程,也有激活素表达的增高。
(6)Fibrosin纤维母细胞刺激因子-1(fibroblast-stimulatingfactor-1),
是由CD4+淋巴细胞产生的分子量60 kD的细胞因子,该细胞因子与其它纤维母细胞生长因子相似,能结合肝素。Fibrosin能刺激纤维母细胞和HSC增殖,在培养HSC,fibrosin能上调FN mRNA表达。也能刺激纤维母细胞增加胶原的产生。
4抑制纤维化的细胞因子
纤维化形成过程中,细胞在产生致纤维化细胞因子的同时,也释放一些抑制纤维化的细胞因子,如肝细胞生长因子(HGF)和IFN-γ,它们具有抑制纤维化发生发展的作用。
(1)肝细胞生长因子(hepatocytegrowth factor,HGF)
HGF先是由1984年日本Nakamura和1985年美国Michalopoulos分别报道的,其分子量为82000,是由728个氨基酸组成的多肽,为一异二聚体,由轻链和重链组成。属不耐热多糖蛋白。HGF主要由间质细胞(如成纤维细胞、巨噬细胞等)产生。HGF通过与特异性膜受体结合而发挥其多样生物学作用,调控细胞生长、分化,除促有丝分裂活性外,还作为一离散因子(scatter factor,SF)促进细胞扩散迁移,诱导多种上皮细胞形成分支管状结构。HGF对肝细胞和多种上皮细胞具有很强的促增生作用。HGF给药或基因治疗对肝硬化、肾纤维化、肺纤维化等有明显治疗效果。
某些器官纤维化的形成不仅与TGF-β表达增加有关,而且还与HGF表达降低有关。HGF可对抗TGF-β的许多生物学活性,具有抑制纤维化的作用;TGF-β可刺激ECM积聚,而HGF则能通过增加MMP的表达和减少TIMP-1和TIMP-2的表达,促使ECM降解;HGF能明显抑制TGF-β表达和MFB形成;TGF-β和AngⅡ能对HGF的局部分泌进行负调节,这负调节在肾纤维化的发生中起重要作用。近期还证明,HGF能明显阻断由TGF-β介导的肾小管上皮细胞向MFB转变,减少α-SMA表达和上皮细胞标志E-钙粘着蛋白(E-cadherin)的丧失。
(2)干扰素
IFN-γ是重要的免疫调节因子,能抑制纤维母细胞激活和胶原基因表达。有研究证明,IFN-γ能明显抑制博莱霉素诱导的小鼠肺病理改变和肺纤维化区TGF-β蛋白表达,降低前胶原纤维αI和αⅢmRNA表达及羟脯氨酸含量的增加。用IFN-γ治疗人肝纤维化已取得较好疗效。IFN-γ能抑制HSC增殖和激活,降低α-SMA、I、Ⅳ胶原及FN mRNA表达水平。IFN-γ能影响I和Ⅲ型胶原的合成,使培养的纤维母细胞胶原产量下降,其作用部位发生在前胶原mRNA。原代培养HSC加入IFN-γ后,I、Ⅲ型胶原及FN mRNA表达水平降低。
(三)血管活性物质的作用
1肾素-血管紧张素系统(RAS)
是作用于循环系统激素,具有调节血容量和血压中起重要作用。近年发现它也是一局部内分泌系统。局部RAS并不依赖于循环中的肾素、血管紧张素和血管紧张素转换酶(ACE),而是独立地通过自分泌和旁分泌的方式发挥生理和病理作用。肾、心、血管、肾上腺和脑等均有局部RAS。AngⅡ是该系统的效应分子,主要通过与其特异性受体结合而发挥生物学效应。AngⅡ除具有调节血流动力学的作用外,近期发现它还作为一种生长因子和促纤维化因子影响细胞的增殖和分裂,即非血流动力学作用。
RAS在肾纤维化、心肌纤维化、肺纤维化中起着重要作用,在其它器官纤维化形成中的意义近年也引起注意。AngⅡ在肾小球硬化和肾间质纤维化的作用机制:
①影响全身及肾脏的血流动力学,升高肾小球内压力,导致肾小球硬化;
②诱导肾小球系膜细胞及肾间质纤维母细胞的增殖和肥大,活化肾固有细胞和肾间质纤维母细胞,增加ECM蛋白的表达和合成,引起ECM积聚;
③可刺激TGF-β和血浆纤溶酶原激活物抑制剂(PAI-1)的表达,从而减少ECM的降解;
④对单核细胞具有趋化作用,增加趋化因子的表达;
AngⅡ能以时间和剂量依赖方式增加TGF-β1 mRNA和蛋白表达,并促使TGF-β1活化;在大鼠肾小球系膜细胞加入AngⅡ,能直接引起PAI-1增加及通过TGF-β介导的PAI-1持续表达;血管紧张素转换酶抑制剂和AngⅡ受体拮抗剂可减轻肾小球硬化和肾间质纤维化的程度。
RAS在心肌纤维化及心室重塑中的作用:
心脏除受循环中RAS的作用外,还受心血管局部RAS的影响。AngⅡ可以自分泌或旁分泌的方式作用于心肌和血管的特异性受体,通过多种信号转导途径影响心血管功能。在这方面研究得更多的是高血压心脏病,其他如缺血性心脏病、扩张型心肌病等引起的心肌纤维化,也有RAS参与。
AngⅡ可能对肝和肺纤维化的发生发展有一定影响。
在体外培养的人HSC已发现有AngⅡ1型受体存在,AngⅡ能刺激HSC增殖和收缩。
2内皮素(endothdin,ET)
内皮素是迄今所知非常强的缩血管物质。主要由血管内皮细胞合成,通过自分泌或旁分泌等方式发挥生物学作用。人和哺乳动物体内有3种ET(ET-1、ET-2和ET-3)和3种受体。ET在肾脏、心脏、肝、肺等器官纤维化发生发展中有重要作用。
ET通过血流动力学和非血流动力学途径参与肾脏纤维化的发生:
①引起肾小球血管收缩,升高肾小球内压力;
②刺激系膜细胞增殖和合成ECM,释放TNF、PDGF及刺激肾髓质产生超氧阴离子和过氧化氢等;
③升高TIMP的水平,减少ECM降解;
④具有血管紧张素转换酶(ACE)样活性,可使组织局部AngⅡ合成增加,后者反过来刺激内皮细胞合成更多的ET-1;
⑤除了上调TGF-β表达外,ET-1可通过直接刺激肾脏纤维母细胞增殖、增加ECM合成及减少胶原酶活性而促进肾问质纤维化。
ET对心肌纤维化的作用表现:
可促进心肌细胞合成和释放AngⅡ。ET具有ACE样活性,可促进Ang I转化为AngⅡ。因此,认为在心血管很可能存在一个区域化的ET-AngⅡ相互作用系统,在生理情况下参与局部循环稳态的调节,在病理情况参与心肌纤维化和心室重塑的发生发展;ET可引起肾上腺释放醛固酮,其作用比AngⅡ强,ET是醛固酮合成与释放的强效调节剂;ET在促进心肌纤维母细胞增生和胶原蓄积方面可起重要作用,并可降低胶原酶活性。
新近研究证明,过度表达人类ET-1的转基因小鼠,可发生肾小球硬化和肾间质纤维化。特异ET受体阻断剂能减轻肾纤维化的程度。HSC表面有大量ET受体,ET-1可刺激这些细胞活化,在活化的HSC表面ET受体表达明显上调。ET受体拮抗剂能阻断实验性肝纤维化大鼠胶原合成和沉积。在实验性大鼠肺纤维化,ET-1的表达也增加,阻断ET受体可明显减轻肺纤维化。在特发性肺纤维化病人的肺组织ET-1的表达增加,并通过调节肺纤维母细胞的增殖和a-SMA的表达参与肺纤维化的发生。在ET-1转基因小鼠的研究进一步证明,ET-1过度表达与肺纤维化有关。
除上述细胞因子和血管活性物质外,其它细胞因子、趋化因子、粘附分子、细胞凋亡、氧化应激、醛固酮、一氧化氮以及某些ECM成分等,在不同器官纤维化的不同发展阶段也起一定作用。