作者:钟天映陈媛媛毕利军
作者单位:中国科学院生物物理研究所结构与分子生物学,北京,100101
刊名:生物化学与生物物理进展2009,36(10)
摘要:
三位美国科学家(Elizabeth H.Blackbum,Carol W.Greider和Jack W.Szostak)因发现“端粒和端粒酶是如何保护染色体的”获得了2009年的诺贝尔生理学或医学奖,端粒是染色体末端的特殊结构,对染色体有保护作用,而端粒酶能合成端粒,使得端粒的长度和结构得以稳定,研究发现,端粒长度和端粒酶活性与细胞的寿命以及很多疾病发生直接相关。随着研究的不断深入,实现合理控制端粒的长度和端粒酶活性成为可能,这将有助于攻克医学领域“癌症、特定遗传病和衰老”三个重要领域的难题,有望研究开发出潜在的新疗法。
2009年10月5日,瑞典皇家科学院诺贝尔奖委员会宣布将2009年度诺贝尔生理学或医学奖(TheNobel Prizein Physiology or Medicine)授予3位美国科学家伊丽莎白·布莱克本(Elizabeth H.Blackburn),卡萝尔·格雷德(Carol W.Greider)和杰克·绍斯塔克(Jack W.Szostak),以表彰他们“发现端粒和端粒酶是如何保护染色体的”。在染色体的末端部分有一个像帽子一样的特殊结构,这就是端粒(图1)。Blackburn和Szostak发现端粒的一段特殊DNA序列能使染色体不被降解,而Greider和Blackburn则找到了帮助端粒合成的分子——端粒酶。他们的发现阐明了端粒酶的作用——使端粒的长度和结构得以稳定,从而保护染色体。细胞随着端粒的变短而衰老,而当端粒酶的活性足以维护端粒的长度时,细胞将会延迟衰老。在癌细胞获得永生性这一过程中,端粒酶的激活起了非常重要的作用。相反,一些遗传病正是由于端粒酶的活性缺陷将导致细胞的损伤。正是由于三位科学家的开创性工作让人们知道端粒和端粒酶不仅与染色体的特质和稳定性密切相关,而且还涉及细胞的衰老与损伤、癌症的发生等方面。
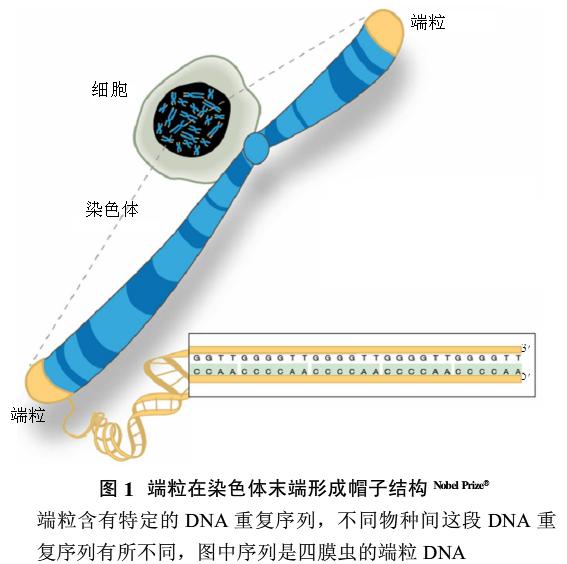
1端粒和端粒酶的发现及其结构与功能研究
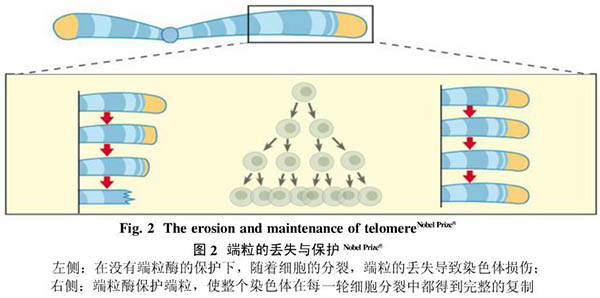
对端粒的研究可追溯到20世纪70年代初对DNA聚合酶特性的深入研究引申出的一个染色体复制问题。研究发现,染色体并没有随着复制后RNA引物的降解而缩短,其自然末端也没有相互融合,这些都暗示可能存在一个特殊的结构来避免染色体缩短和相互融合的发生。在逐渐明晰了染色体末端特殊结构的概念之后,人们给了它一个专有名称——端粒(telomere)。其实早在20世纪30年代,诺贝尔奖得主Hermnn Muller和Barbara Mcclimock已经观测到染色体的末端结构在避免染色体之间的融合中起了重要的作用,从而猜测它可能有保护染色体的作用。1978年,Blackburn发现了富含小染色体的模式生物四膜虫的端粒含有许多重复的5’-CCCCAA-3’六碱基序列,与此同时,Szostak发现微型染色体在导入酵母后会很快被降解这一现象,于是这两位科学家将四膜虫的CCCCAA序列偶联到微型染色体上并导入酵母,结果发现这段端粒序列的加入使得微型染色体免受降解,从而证实了端粒对染色体的保护作用。进一步的研究发现,端粒可通过形成t-loop紧凑结构,或者与Shelterin等端粒保护蛋白结合,从而防止染色体降解、避免末端融合,进一步调节细胞生长。随着体细胞的不断增殖,端粒会逐渐缩短(图2),当端粒缩短至一定程度,细胞停止分裂,进入静止状态,故有人称端粒为正常细胞的“分裂钟”(mistosis clock)。端粒DNA序列既有高度的保守性,如原生动物、真菌、高等植物及高等动物中期序列都很相似,又有种属特异性,如四膜虫重复序列为GGGGTT,草履虫为TTGGGG,人类和哺乳动物为TTAGGG。
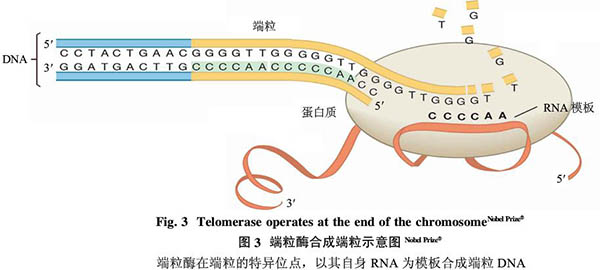
在1984年报道酵母端粒序列的同时,Blackburn实验室发现了一个有趣的现象:带着四膜虫端粒DNA的人工染色体导入到酵母后,被加上了酵母的端粒而不是四膜虫的端粒序列。由于端粒是由重复序列组成的,当时人们普遍猜想同源重组是延伸端粒、补偿染色体末端隐缩的机制。但是同源重组只能复制出更多自身的序列,为什么在四膜虫端粒上加的是酵母的端粒序列而不是四膜虫端粒本身的序列呢?难道酵母中存在专门的“酶”来复制端粒DNA?随后,Blackburn实验室用四膜虫的核抽提液与体外的端粒DNA进行温育,证明确实存在一种“酶”能延伸端粒DNA,这种酶后来被命名为“端粒酶”(telomerase)。之后,Morin从人宫颈癌细胞株HeLa中鉴定了端粒酶的存在,并证实它是一种核糖核蛋白。端粒酶通过引物特异识别位点,以自身RNA为模板,在染色体末端合成端粒DNA,使端粒得以延长,为后续DNA聚合酶合成完整的染色体提供了平台(图3)。
人类端粒酶主要由RNA成分(hTR)、端粒酶相关蛋白1(hTEP1)和催化亚单位(hTERT)三部分组成。hTR长约560 nt,其中有11个碱基(5’-CUAACCCUAA-3’)与人类端粒序列5’TTAGGG-3’互补。与此区互补的反义寡核苷酸能抑制端粒酶活性,而这段RNA的突变会导致端粒酶活性的改变。hTEP1的mRNA表达并不限于有端粒酶活性的组织和细胞系,各组织的水平差异与端粒酶的活性无关,因此,端粒酶活性表达并不是由TEP1决定的,但hTERT则是端粒酶活性所需要的。作为RNA依赖的DNA聚合酶,区别于一般的蛋白逆转录DNA聚合酶,hTERT可识别单链富含G的寡核苷酸引物,以其RNA组分的碱基为模板与端粒重复序列进行碱基互补配对,在合成、延伸碱基序列中起催化作用。Skordalakes和同事克隆了赤拟谷盗(Tribolium castaneum)的端粒酶TERT并收到了三维晶体结构。如图4所示,TERT的晶体结构由三部分组成:RNA结合区(TRBD)、逆转录区(the reverse transcriptasedomain)和羧基末端延伸区(carboxy-terminalextension,CTE)。TRBD主要由螺旋组成,含有CP和T两个保守区域,与单链和双链RNA结合。逆转录区由α螺旋和β折叠组成,呈现像手指(Fingers)和手掌(Palm)形状的结构。而CTE区由延长的螺旋组成,其表面有长的loop结构,这种新的二级结构折叠方式使CTE区成为TERT的“拇指”(Thumb)。此研究结果为揭示TERT与RNA合作合成DNA的过程提供了重要的结构信息,为根本性理解端粒酶及其潜在的医疗应用迈出了重要的一步。

2端粒与细胞衰老
细胞的复制期限被认为是由导致衰老的两个机制决定,一个是累积的DNA损伤,另一个是端粒的进行性缩短。1973年,Olovnikov先提出关于端粒丢失同衰老的关系理论,认为由于末端复制而造成的端粒丢失很可能调节了细胞的寿命。Bodnar等通过激活端粒酶的活性,使端粒得以延长,从而延长了人类正常细胞的生命周期,有力证实了端粒与衰老的关系。在Werner综合症(一种罕见的人类早衰疾病)的研究中,已有多个证据表明了端粒异常与其紧密相关。Crabbe等认为,端粒异常是WRN细胞基因组不稳定的原因之一。Stewart的研究结果表明,是端粒单链悬垂的侵蚀而非整个端粒长度的变化,导致了衰老这种状态。Michishita等研究了人类SIRT6,一种具有乙酰基转移酶活性的染色质相关蛋白,它可调节端粒染色质,其缺失导致的异常端粒结构与Wemer综合症中的特征相似。端粒与衰老研究的不断深入,为进一步了解衰老的分子机制,提供了重要的线索。
3端粒与DNA损伤应答
真核线性染色体端粒的化学构成和染色体内的损伤、断裂DNA十分相似,然而DNA修复机器却能够将两者区分,其中与端粒结合的Shelterin蛋白复合物起了关键的作用。Shelterin是由6个蛋白质——TRF1、TRF2、TIN2、RAP1、TPP1和POT1,组成的复合物,可使端粒DNA不被DNA损伤应答(DNA damage response,DDR)所识别。其中,蛋白TRF2和POT1l分别抑制由ATM和ATR介导的DDR途径,从而避免应答的发生。随着细胞的分裂,端粒逐渐变短,当缩短到一定程度时,将会激活ATM和ATR介导的DDR途径,细胞死亡或进入衰老。
然而,许多研究表明,与DNA损伤应答相关的蛋白质出现在端粒上,并直接或间接参与端粒的维护。DNA双链断裂修复蛋白的缺陷,如ATM、Ku、DNA-PKcs、RAD51D、MRN复合物的缺陷,会导致端粒的错误代谢。因此,功能性端粒需要和DDR修复蛋白相互作用。总体来说,现在观察到的端粒和DNA损伤修复途径存在着两极关系。一方面,正常端粒需要避免DNA损伤应答的激活。另一方面,端粒复制和保护又需要DDR相关蛋白的参与。
4端粒与肿瘤发生
正常情况下人类体细胞端粒酶的检测结果是阴性的,但在400个肿瘤样品中,85%以上能检测到端粒酶的存在。细胞的端粒酶活性因某些原因被激活,使端粒不断维持在一定的长度,细胞因此逃过死亡而成为无限增殖的细胞——肿瘤细胞。端粒酶活性与恶性肿瘤的这种密切关系,为肿瘤的诊断提供了有效的标志物。端粒酶是正常细胞转变为肿瘤细胞的关键性物质,是抗肿瘤治疗的重要靶点。而且,正常细胞与肿瘤组织中端粒酶的表达、端粒的长度和细胞动力学的差异,使得选择端粒酶作为药物靶标成为相对平安的治疗手段。通过抑制端粒酶活性来治疗肿瘤的研究进展迅速,其中长度为13-mer的寡核苷酸GRN163能与人类端粒酶RNA亚单位hTR互补结合,从而抑制端粒酶与端粒的结合,达到抑制端粒酶活性的效果,已经被应用于临床。
5端粒与干细胞功能
端粒酶的表达对于维持干细胞自我更新能力和复制潜能具有重要意义。伴随器官的老化,端粒缩短,而端粒酶的功能缺失突变又会加剧端粒缩短。造血干细胞在表达端粒酶的情况下,随着年纪的增长其端粒仍然会丢失,但B细胞和T细胞的激活能上调端粒酶的活性,从而减少端粒的侵蚀甚至使端粒延长。患有先天性角化不良(dyskeratosis congenkal,DC)、特发性肺纤维化(idiopathicpulmonary fibrosis,IPF)和再生障碍性贫血(aplasticanemia)的病人其端粒酶发生突变会导致组织器官更新能力的过早丧失,其寿命也因此缩短。这些现象均表明端粒长度和端粒酶活性与干细胞的细胞周期紧密联系,且直接影响干细胞的分化和自我更新的能力。
6展望
三位科学家的发现使我们了解到端粒不仅与染色体的个性特质和稳定性密切相关,而且还涉及细胞的寿命、衰老与死亡等等。同时我们也应认识到端粒和染色体等虽然与细胞老化有关,进而影响衰老,但并非仅有的因素,“生命衰老是一个非常复杂的进程,它有许多不同的影响因素,端粒仅仅是其中之一”。端粒和端粒酶的发现是有关人类衰老、癌症和干细胞等研究的谜题拼图中重要的一片,此发现使我们对细胞的理解增加了新的维度,清楚地显示了疾病的机理,并将促使我们开发出潜在的新疗法。
尽管已有越来越多的有关端粒与端粒酶的研究成果,但这一领域仍然存在着不少有待解决的问题。端粒与端粒保护蛋白质之间是如何相互协调从而维持端粒的结构;究竟是由于端粒缩短到一定程度还是某些特异的末端结构导致染色体的不稳定性;正常的发育过程中端粒酶是如何调控,而在肿瘤细胞中又是怎样被激活的。随着研究的不断深入,端粒维护的机制将被更完善地阐述,针对衰老、癌症、遗传病的治疗方法也会有进一步的改进。