周崧易静
《细胞生物学杂志》2006年05期
【作者单位】:上海交通大学医学院细胞生物学教研室
【摘要】:
活性氧(reactive oxygen species,ROS)是生物体内一类活性含氧化合物的总称,主要包括超氧阴离子、羟自由基和过氧化氢等。细胞内有多种部位能生成ROS,主要包括线粒体、内质网、NADPH氧化酶复合体、脂氧合酶系、环氧合酶系等。静息条件下,细胞内ROS的水平被控制在很低的范围。而在细胞受到各种生理或病理因素作用时,当多种细胞外信号分子作用于其膜受体,ROS生成可以受到受体活化的诱导而“有目的”地快速增加,从而作为细胞内信号分子参与细胞增殖,分化和凋亡等各种细胞行为。
活性氧(reactive oxygen species,ROS),特别是诸如超氧阴离子(O2·-)、羟自由基(·OH)和过氧化氢(H2O2),作为生命体有氧代谢的中间产物,多年来主要被看作对大分子有损伤作用的毒性物质。ROS对细胞有益的概念先是被作为动物机体防御系统的重要组成部分而提出的,早期的工作重的重要组成部分而提出的,早期的工作重点主要集中在中性粒细胞等吞噬细胞的呼吸爆发产生的ROS作为毒性分子对病菌的杀伤上,同时也涉及细胞内高浓度ROS的生成对细胞的杀伤作用。然而,研究证明,ROS有作为细胞内信号分子所拥有的各种特性,如:
(1)当细胞受特定刺激,或受到细胞外信号分子如配体激发时能快速生成;
(2)能在细胞内快速扩散;
(3)生成后能引起该细胞或临近细胞的特定行为;
(4)在需要关闭或复原时能通过多种途径迅速移除信号;等等。
近年来的研究发现,ROS作为一种重要细胞内信号分子参与了细胞增殖、分化和凋亡,以及许多重要的细胞行为。ROS在静息细胞内的生成速率主要受到生成部位的代谢状态和氧还状态的制衡,此时细胞内ROS被控制在一个很低的范围内,一旦细胞受到相关配体信号激发,往往伴随着细胞内ROS水平的迅速提升,继而产生细胞内一系列的信号转导。现就目前BOS在细胞内的生成部位以及受到细胞外信号分子诱导后ROS的生成机制的研究进展进行简要论述。
1细胞内ROS的生成部位
细胞内ROS主要依赖细胞质膜和内膜上氧化酶生成。原则上,任何涉及电子传递的蛋白质或酶系都能导致“副产物”ROS的生成。由于细胞内强大的还原系统的存在,大多数非“目的性”生成的ROS多被立即清除以保持胞内氧化还原状态的平衡。
1.1呼吸链
线粒体是细胞内很大的ROS产地。在胞内还原环境下,大约有1%~2%的O2耗在呼吸链酶复合体Ⅰ和Ⅲ处被漏出的电子还原成为ROS也就是说,线粒体的电子漏是细胞内ROS的主要来源。但是由于线粒体内高浓度的SOD存在,以及生成的O2·-其自身扩散出膜能力差,只有少量形成的H2O2扩散入胞浆,胞浆ROS水平被控制在一个低而稳定的水平。
过去对这部分ROS参与细胞信号转导并不重视,近来有证据显示TNF-α和IL-1介导的细胞凋亡为线粒体源ROS所调控。TNF-α能激活细胞线粒体生理性解偶联机制,通过使连接呼吸链酶复合体Ⅰ、Ⅲ的CoQ半醌形式(QH)稳定性增加,从而增加ROS生成、促进线粒体肿胀以及细胞色素c释放,导致细胞凋亡。另外,有报道提出在受抗原刺激下扩增T细胞的凋亡过程存在两条途径,分别为活化诱导的细胞死亡(activation-inducedcell death AICD)和活化T细胞的自发死亡(activated T-cell autonmnousdeath ACAD),这两条途径都有可能受到线粒体源的ROS所调控。
在对心肌细胞缺血再灌的研究中发现,细胞内产生的高浓度ROS能通过PKC和MAPK途径诱导蛋白酪氨酸磷酸酶(proteintyrosine phosphotasa PIP)持续激活使线粒体肿胀,而细胞通过线粒体体积依赖型和非依赖型两条途径抑制糖原合成激酶-3β(GSK-3β)的合成,提高了细胞对ROS的敏感阈从而起到保护细胞的作用。
线粒体作为氧感受器介导缺氧所诱导的基因转录也需要ROS参与。新近有研究显示,在整合素介导的细胞信号中,线粒体来源的ROS能启动细胞分化,起到抗凋亡的作用。
1.2内质网(ER)
ER是细胞内另一个生成ROS的膜性细胞器。不同于线粒体,ER中的细胞色素P-450和b5家族通过氧化不饱和脂肪酸和外源生化物质来生成O2-/H2O2。虽然鲜有关于ER生成的ROS和细胞信号之间直接联系的报道。但有研究证明了ROS能通过改变非受体型酪氨酸激酶活性等途径影响到ER诸如蛋白质折叠和分泌等的功能。在研究TNF-β介导肝细胞凋亡过程中也发现线粒体和ER细胞色素P-450 1A1生成的ROS共同参与凋亡的细胞信号过程。
1.3 NADP源化酶复合体
结合在细胞质膜上的NADPR氧化酶复合体是生成ROS的另一个重要部位,也是目前研究发现大多数生长因子和激酶激发的ROS生成部位。早对于NADPH氧化酶的研究是基于吞噬细胞的呼吸爆发,其复合体是由质膜上的p22phox、gp91phox组成的细胞色素b558复合体和胞浆中的磷酸化的p47phox、p67phox和p40phox组成,上述成分与两个激活后由GTP结合的G蛋白p21Rac和Rap1A组装成活化的氧化酶,产生ROS。
近年来,不断发现在成纤维细胞、内皮细胞、血管平滑肌细胞、肾系膜细胞、甲状腺细胞等非吞噬细胞内,存在与吞噬细胞NADPH氧化酶类似的、具有氧化活性的酶,这些酶被叫做Nox。在非吞噬细胞内,ROS的生成远低于吞噬细胞,常常都显示对细胞增殖、分化的诱导作用,说明ROS在此扮演是细胞内信号分子的角色。目前认为非吞噬细胞内的ROS生成量低是由于其NADPH氧化酶组成成分的低表达,特别是Nox的含量,大约只有白细胞的1%~3%所致。这些NADPH氧化酶胞质成分与吞噬细胞内的相同,而其主要的活性反应中心细胞色素b558的β亚基gp91phox则存在多种类似物,由于它们功能和结构相近,如都含数个穿膜片段、上有含参与电子传递的Fe离子的血红素结合位点、胞内结构域有FAD和NADPH结合位点,已被归类为Nox家族,目前发现的有Nox1、Nox2、Nox3、Nox4、Nox5以及Duox亚族(图1)。
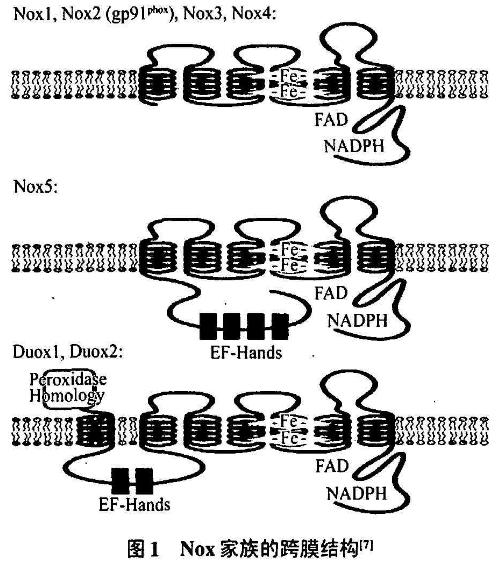
1.3.1 Nox2
Nox2(Aka,gp91phox)即白细胞内发现的gp91phox,其结构为一个主要由6个疏水穿膜片段串连而成的大小为91 kDa的糖蛋白,其中胞质端为结合FAD、NADPH的保守位点,电子则由蛋白质中心的2个血红素传递给胞外的氧分子以生成O2-。
1.3.2 Nox1
Nox1(Vbx-1,NOH-1)在人结肠中高表达,在前列腺、子宫和血管平滑肌内次之,与Nox 2有56%的同源性。在血管平滑肌组织中,Nox1在增殖细胞中的表达要远高于静止期细胞,并且其表达受到PDGF、ANGⅡ、PGF2α等生长因子的调控,可以推测Nox1与细胞生长以及成血管信号放大有关。新研究表示,虽然在结肠肿瘤组织中存在Nox1的高表达,但尚无证据表明其与肿瘤细胞的增殖有关,可能Nox1在结肠上皮细胞分化中起了其他的作用。
1.3.3 Nox3
Nox3(gp91-3)mRNA过去只被发现在某些胎儿组织,如肾脏、脑以及头骨处表达,其结构与Nox2有58%的同源性。新近研究发现,Nox3在内耳道前庭以及耳蜗上皮细胞内表达。体外实验发现在p47phox、p67phox,或在直肠NADPH氧化酶Nox组织物1(Nox organizer 1)和Nox激活物1(Nox activator1)的存在下,Nox3能产生高浓度的ROS推测与耳毒性药物导致听力损伤的病理机制有关。
1.3.4 Nox4
Nox4(Renox Kox-1,Kox)存在于人肾皮质,特别是远端小管上皮细胞和系膜细胞内,与Nox2有39%同源性。近期大量研究表明Nox4作用可能是作为氧感受器调节EPO的合成以及肾脏细胞的生长和凋亡。对于Nox4的肾外作用,Yang等回发现Nox4和Nox2存在于小鼠破骨细胞中,可能为骨质重吸收提供一个氧化环境。
1.3.5 Nox5
Bbx5在睾丸精原细胞以及在淋巴细胞丰富的脾脏和淋巴结内表达。其结构为一种Ca2+激活的gp-91phox蛋白类似物,但仅与NOX2有27%的同源性。其功能除了被钙激活生成ROS外,还能作为质子通道平衡胞内外电位差和pH值。目前主要观察到Nox5与精原细胞成熟,如人精子活力及顶体反应的氧化改变有关。另外,在脾脏中,Nox5可能是T、B细胞被激活后产生ROS的部位,介导了T、B细胞的增殖分化。
1.3.6 Duox亚族
Duox亚族包括Duox1(Thox1)和Duox2(Thox2,p138TOX),分别存在于甲状腺、小肠和结肠中,人类Duox1和Duox2序列有83%相同。在人甲状腺滤泡中,Duox存在于滤泡细胞尖端表面,因此可能其功能与甲状腺过氧化酶介导的碘化反应及甲状腺球蛋白的酪氨酸残基的交联有关。Duox2突变造成先天性甲减证明Duox2在甲状腺素的合成中起到重要的作用,而Duox1在甲状腺组织中的作用目前还不明确。在人的腮腺导管、结直肠黏液腺和主要气道壁的黏液腺上也存在Duox,可能其产生的H2O2与乳酸过氧化酶的抗菌作用有关。
1.4脂氧合酶系、环氧合酶系
脂氧合酶(lipoxygenase,LOX)和环氧合酶(cyclooxygenase,COX)是细胞脂类代谢中将花生四烯酸代谢为脂类过氧化物和ROS的酶类。目前作为细胞信号研究的主要是COX-1、COX-2、5-LOX和12-LOX。它们生成的ROS以及活性氮(RNS),单独或共同通过多种信号途径参与改变细胞葡萄糖摄取、受体活性和细胞因子释放等活动,终可导致细胞死亡。比如,白介素IL-1β在类淋巴细胞激活NF-κB的过程依赖5-LOX产生的ROS。Chiarugi等也发现参与细胞黏附过程的信号转导的ROS是由LOX生成的,而非先前认为的由NAPDH氧化酶生成。
1.5其他
另外,核膜上的细胞色素氧化酶系和电子传递系统类似于ER膜上的,也能生成ROS。但是据现有研究发现,核膜电子漏出所产生的ROS对细胞DNA有破坏作用。还有包括γ-谷氨酰转肽酶、黄嘌呤/黄嘌呤氧化酶系等酶都能产生ROS,但至今还缺乏关于它们参与细胞信号转导的直接证据。
2信号配体诱导的ROS生成
所有的多细胞生物都是通过一个由胞外和胞内信号组成的高度复杂的信号网络来控制其一系列的生物学行为,包括生长发育消亡、内环境稳定、组织损伤的修复等等。细胞外信号通常包括物理性和化学性两类。所谓化学性的细胞外信号主要指细胞因子、生长因子、激素和神经递质等。这些信号就是作为配体通过激活细胞表面或细胞内的特异性受体见下述),进而激活胞内信号转导起到调控细胞行为的作用。在此过程中细胞内ROS快速而一过性升高,与配体-受体相互作用紧密偶联,往往对后继的信号转导发生介导和调控作用。
2.1 TNF-α受体
TNF-α受体在被TNF-α激活后引起信号转导过程中生成ROS的现象得到大量报道。关于TNF-α的研究发现,由TNF-α诱导产生的ROS能激活转录因子NF-κB及其基因转录,从而调节细胞的增殖、分化;另一方面,TNF-α介导的细胞凋亡的死亡信号传递过程中,caspase-3也能激活线粒体外膜通透性改变、细胞色素c释放和ROS生成从而对整个凋亡过程起到反馈放大的作用。
目前关于TNF-α膜受体激活线粒体产生ROS的具体机制仍不明确。有报道说,L929细胞TNF-αR55受体在激活后其膜内死亡结构域能诱导线粒体向核周易位和聚集,从而介导细胞凋亡。另外,配体激活后能在胞浆内连接TNFR并诱导其三聚化的TNF受体联系因子(TRAF2)和受体相互作用蛋白(RIP),为ROS生成和TNF的信号的必须效应分子。
2.2酶联受体
2.2.1受体酪氨酸激酶(receptortyrosine kinase,RTK)
很多生长因子结合的RTK都能激活ROS生成,通过对胞内信号转导的加强或氧还状态的改变影响细胞内主要的MAPK途径。其中研究比较早的是血小板来源的生长因子(PDGF)和上皮生长因子(EGF)受体。Sundaresan等在报道了PDGF通过提高胞内H2O2水平诱导酪氨酸磷酸化,从而启动MAPK信号途径的机制。Bae等报EGF受体激酶参与了EGF介导的胞内H2O2生成,他们否定了先前EGF受体自磷酸化的理论,阐述了是H2O2通过抑制PTP活性间接激活生长因子受体激酶即RTK活性的。Kamata等也阐述了EGF受体的二聚化或寡聚化依赖H2O2对PTP的抑制的类似观点。
近年来的研究发现,很多生长因子受体诱导ROS生成的同时胞内Rac1/Ras水平也相应升高,而Rac1能通过GTP获能后与NADPH氧化酶的关键部分p67phox结合,从而激活NADPH氧化酶生成ROS。因此,生长因子受体自己被激活后通过Rac1激活NADPH氧化酶生成ROS,从而将信号往下游转导。目前的研究还发现Rac1活性能通过不同细胞内存在的前馈和反馈机制被放大或关闭,该机制受细胞内氧还状态调控。另外,也有报道称整合素能通过Rac GTPase诱导线粒体HOS生成以改变细胞形态,调控细胞凋亡。目前也有研究表明5-LOX生成ROS是Rac-1介导的又一条细胞信号途径。
2.2.2受体丝氨酸/苏氨酸激酶(receptor serine/threoninekinase,RS/TK)
目前在哺乳动物细胞内发现的所有RS/TK都属于TGF超家族,它们的作用机制都是通过Ⅰ型和Ⅱ型受体的异源复合体磷酸化激活SMAD蛋白和由该蛋白质介导的细胞信号途径。目前,已证明有很多细胞在TGF-β1刺激下有ROS生成,并产生多种效应,而ROS的来源可能不是膜上NADPH氧化酶。不同于RTK偶联的生长因子,大多数TGF-β1都抑制其靶细胞的生长。Shibanuma等报道,在TGF-β1诱导的小鼠成骨细胞在分化过程中的生长抑制和DNA合成减少需要H2O2介导。不过,TGF受体作用生成ROS的直接靶点至今仍未被找到。
2.2.3 G-蛋白偶联受体
细胞表面受体中大部分就是G-蛋白偶联受体,其中有很多被发现能介导ROS生成,例如血管紧张素Ⅱ(ANGⅡ)、5羟色胺(5-HT)、血栓素、内皮素(ET)等的受体。
在血管平滑肌细胞中发现ANGⅡ能诱导NADH/NADPH氧化酶依赖的ROS生成,并且此事件与高血压有关。目前已发现依赖ANGⅡ的ROS生成在生理上能产生多种作用,包括血管收缩、血管平滑肌细胞肥大、细胞存活激酶Akt/PKB的激活、胰岛素样生长因子-1受体的激活和IL-6的生成等。类似过程也见于5-HT。5-HT在血管平滑肌细胞能诱导依赖NADPH氧化酶的ROS生成,而且这种ROS生成是5-HT激活MAPK、诱导基因表达的上游事件。
2.2.4离子通道偶联受体
神经元快速电兴奋信号转导是通过突触离子通道快速的开放和关闭实现的,而离子通道偶联受体的配体大多为神经递质(乙酰胆碱、5-HT、谷氨酸、α-氨基丁酸等)。目前发现在神经元细胞内谷氨酸能诱导ROS生成,其机制可能有依赖胞内离子浓度途径和非依赖胞内离子浓度途径两种。有报道说该过程是由胞内Zn2+介导的线粒体去极化,细胞色素c大量释放使ROS浓度上升导致。在心肌细胞内也发现乙酰胆碱能激活K-ARP通道开放和线粒体ROS生成以作为细胞信号介导心肌细胞缺血前适应,然而一旦缺血造成过量ROS生成又将诱导心肌细胞的死亡。
3小结
综上所述,信号配体作用于细胞时往往诱导细胞内ROS快速生成,ROS的来源以质膜NADPH氧化酶为多见,产生的ROS随即介导了相应的细胞内信号转导途径。信号转导的生物学效应是由配体受体相互作用以及不同信号途径的相互作用[或称“串话”(crosstalk)]决定的,但ROS常常参与调控该信号途径自身转导和与其他途径的“串话”,从而对结局施加影响。得益于技术手段的飞速发展,ROS在细胞内介导细胞增殖分化以及凋亡信号途径的细节正在逐步被阐明,某些研究成果也对心血管疾病、糖尿病的治疗起到一定的指导作用。但是目前临床上更多的仍是将高浓度ROS作为一种组织毒性分子对待而予以消除。相信随着人们对于ROS生成的目的性、特异性以及生成时机、生成量的调控等问题的了解增多,ROS作为细胞内重要的信号分子将得到更为全面和正确的认识。