——活性氧与细胞的增殖、分化和凋亡及其信号转导途径
景亚武易静高飞汤雪明
《细胞生物学杂志》2003年04期
【作者单位】:上海第二医科大学细胞生物学教研室
上海第二医科大学细胞生物学教研室
上海第二医科大学细胞生物学教研室
上海第二医科大学细胞生物学教研室
【摘要】:
活性氧(reactive oxygen species,ROS)是生物体有氧代谢产生的一类活性含氧化合物的总称,主要包括O2·-、H2O2、·OH等,机体细胞通过多种途径维持ROS产生与消解的动态平衡。近年的研究揭示ROS参与细胞正常的生理过程,与细胞的增殖、分化及凋亡密切相关。不同刺激诱导细胞产生的内源性ROS可作为第二信使,通过改变氧化还原状态调节增殖、分化和凋亡相关的信号转导通路中多种靶分子的活性,决定细胞的命运。
细胞的增殖、分化和凋亡是真核细胞基本的生物学行为,不同的外来信号(或其组合),通过一系列信号转导途径,决定细胞走向增殖、分化或者凋亡。长期以来,活性氧(reaetive oxygen species,ROS)被认为只是一类损伤细胞的毒性物质,近年的研究发现,ROS参与了对细胞增殖、分化和凋亡的信号转导,从而参与了这些重要细胞活动的调控,本文就此作一综述。
一、细胞内活性氧的生成及其调控
1.细胞内活性氧的生成
氧气是多数生物体生命活动的基础物质之一,其作用是参与能量代谢,主要是参与线粒体的呼吸和氧化磷酸化,生成ATP,其终产物主要是水。但是,氧气代谢过程中还可产生一系列中间产物,包括氧自由基如超氧阴离子(O2·-),羟自由基(·OH),以及过氧化氢(H2O2)和单线态氧(1-O2)等,这些物质具有较强的氧化能力,统称为ROS。
线粒体是多数真核细胞产生ROS的主要部位,在有氧呼吸过程中,大部分电子沿呼吸链传递至末端与分子氧结合生成水,但一小部分电子(2%~3%)可由呼吸链酶复合体Ⅰ和Ⅲ处漏出,使得分子氧单电子还原,生成具有较强氧化作用的超氧阴离子(O2·-),并通过特定的化学反应生成羟自由基(·OH)、过氧化氢(H2O2)等。实际上,大部分ROS的起初来源都是O2·-。
正常状态下,线粒体ROS的生成速率主要受线粒体内膜跨膜电位Δψm的控制。近来发现,线粒体中调节氧化磷酸化偶联效率的解偶联蛋白(Uncouplingprotein,UCP)可以引起跨膜H+梯度(ΔμH+)的消解而没有任何能量的产生(称为“质子漏”),这种温和的解偶联(mild uncoupling)引起的“质子漏”可直接降低线粒体Δψm,使得ROS的生成速度降低。
结合在细胞质膜上的酶复合体NADPH氧化酶是产生O2·-另一重要部位,主要由胞浆中的P47phox、p67phox和Rac1/2以及胞膜上的gp91phox和P21phox组成。起初发现该酶复合体存在于吞噬细胞,在外界信号(如细菌脂多糖,细胞因子TNF-α、IL-1、IFN-γ等)作用下迅速活化,产生大量的ROS,形成氧化爆发,以清除入侵的病原微生物。
新近有报道指出,具有NADPH/NADH氧化酶活性的酶也存在于许多非吞噬细胞中。机体多器官平滑肌均发现gp91phox的同源物Nox1,且在小鼠NIH3T3细胞中过表达Nox1,ROS的产生增多。由于NADPH氧化酶具有激活快、失活也快的特点,故认为其产生的ROS可能作为信使分子,在调节机体细胞增殖、分化和凋亡相关的信号传导过程中具有更为重要的意义。
此外,细胞的内质网及一些酶类例如,环氧合酶、脂氧合酶、γ-谷氨酰转肽酶以及黄嘌呤/次黄嘌呤氧化酶系统等也可通过特定的化学反应产生O2·-。
2.细胞内活性氧的消解
(1)抗氧化酶系统及抗氧化小分子
参与抗氧化应激的酶系统主要包括超氧化物歧化酶(SOD)、CAT。SOD包括位于线粒体的Mn-SOD和位于胞浆的Cu/Zn-SOD,主要催化两分子的O2·-形成—分子H2O2和一分子O2。CAT位于过氧化物酶体中,主要催化H2O2形成H2O和分子O2。
此外,一些小分子物质如维生素A、C、E也参与清除氧自由基,防止脂质过氧化,是机体抗氧化防御系统重要的一部分。
(2)巯基还原缓冲体系
还原型谷胱甘肽(GSH)是细胞内分布更广的非蛋白类巯基抗氧化物,通过NADPH依赖的谷胱甘肽还原酶(GR)的催化作用,细胞内还原型GSH与氧化型GSSG保持动态平衡,并已成为表征细胞抗氧化能力的一个重要指标。
硫氧还蛋白(Trx)及其还原酶TrxR,是细胞内抗氧化巯基还原缓冲体系的另一重要成员。Trx的催化活性部位(-Cys-Gly-Pro-Cys-)含有特征性的对氧化还原敏感的半胱氨酸-SH/S2,正常生理状态下,还原型Trx主要位于胞浆,催化各种底物蛋白的二硫键还原为巯基。近期也发现各种刺激引起胞内ROS增高时,Trx易位入核,并直接催化胞核中某些转录因子DNA结合域中半胱氨酸残基(Cys)还原,提高其促进转录的活性,但其确切的转位机制尚不清楚。
细胞内活性氧的生成及消解见图1。
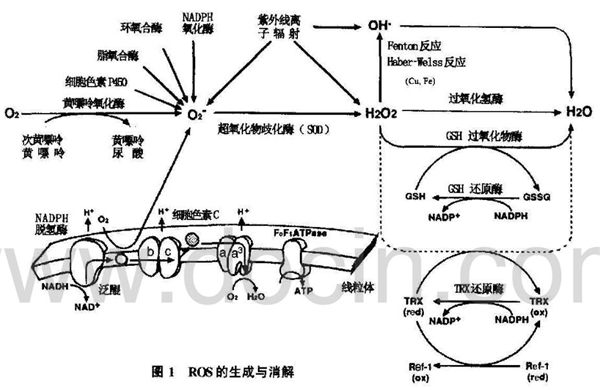
3.细胞的氧化还原平衡
细胞的氧化还原状态常表达为oxidation/reductionstate,或Redox state,正常情况下,机体细胞ROS的产生与消解处于一种动态平衡过程中,细胞内环境氧化还原状态相对稳定。各种刺激(如炎症、紫外线等)引起矛盾双方任何一方力量的相对增强,必将引起细胞氧化还原状态的改变,通过相应的信号转导途径,导致相关基因表达水平的改变,细胞表现不同的生物学效应。
二、活性氧与细胞的增殖、分化和凋亡
早期认为,ROS是细胞有氧代谢的“副产品(byproducts)”,其主要效应是攻击胞内生物大分子,具有一定的细胞毒作用,而细胞内的抗氧化系统把这种毒性效应限制在一定范围之内。近年的一系列研究表明,细胞内ROS水平的轻微增高促进细胞的增殖和分化,而胞内ROS水平的显著增高则快速触发细胞的凋亡。由此可见,细胞内ROS的产生可能不是—种“副产品”,而是“目的性(purposeful)”的产物,在这些过程中,ROS的角色是细胞内一类重要的信号分子。
ROS与细胞增殖的关系在10余年前开始受到关注,新近更是不断有文献报道。例如,在各种生长因子如EGF、PDGF、FGF等引起细胞增殖(平滑肌细胞、肝细胞、PC12细胞等)的同时,往往伴有ROS的产生。又如,直接给予低浓度外源性的H2O2或O2·-同样可以引起平滑肌细胞、成纤维细胞等迅速增殖;而一定程度上干预细胞ROS的产生则抑制其增殖。
新近几年ROS与细胞分化的关系亦研究较多,特别是肿瘤发生与防治的深入研究为这方面提供了的大量证据。如抗肿瘤药物丁酸、阿霉素引起的胞内ROS水平改变是诱导人类K562细胞分化为成熟红细胞的关键一步;同样NGF诱导鼠PC12细胞分化为神经细胞,IL-1诱导胚胎干细胞分化为心肌细胞的过程中均有ROS的产生。
ROS与细胞凋亡的关系研究由来已久,近年来更有大量证据表明ROS参与了多种类型的细胞凋亡。例如,多种凋亡刺激因子(如TNF-α、As2O3等)都可刺激ROS水平的增高,许多ROS的消解剂如GSH、SOD等,均可在一定程度上拮抗凋亡。不少证据还支持ROS参与了凋亡诱导早期线粒体的变化。
三、ROS参与增殖、分化、凋亡相关的信号转导途径
1.引起细胞内ROS水平增高的信号
胞外多种刺激信号均以细胞内ROS作为第二信使,调节细胞走向增殖、分化和凋亡。这些信号主要分为两大类:化学信号和物理信号,前者包括生长因子、细胞因子和激素等,通过与膜上相应的受体分子结合,引起细胞内ROS水平增高,进而激活相关的信号通路,主要参与生理情况下细胞正常的增殖、分化和凋亡的调控。后者包括紫外照射、离子辐射、热、渗透压和机械刺激等,产生的外源性ROS扩散入细胞,或同时激发内源性ROS生成,主要参与应激情况下细胞稳态的调控。
2.细胞信号转导通路
细胞中具有多种信号转导系统,如分裂原激活的蛋白激酶(mitogen-activatedprotein kinases,MAPKs)、Smads及JAK/STAT等,其中MAPKs家族与增殖、分化、凋亡的发生密切相关,并且是重要的氧化还原敏感的(redox-sensitive)信号通路,因此本文对其进行详细介绍。
迄今为止发现的MAPKs信号转导通路主要包括细胞外信号调节激酶(ERK)、c-Jun N端激酶位激激活的蛋白激酶(JNK/SAPK)和P38MAPK三条途径,其共同特征是都包含三个保守的蛋白激酶成分。在胞外刺激信号的作用下,三级蛋白激酶成分顺序激活(MAPKKK→MAPKK→MAPK)。至后激活转录因子,调节特定基因的表达。尽管具有相似的激活机制,但每条途径都有其特异的上游激活剂和相应底物,产生不同的生物效应,如ERK主要接受生长因子的刺激,通过Raf→MEK→ERK通路激活转录因子,其中主要是活化蛋白-1(AP-1)和核因子kappa B(NF-κB)的活性,介导细胞增殖和分化的信号转导;而JNK和P38MAPK主要感受炎症、氧化应激及损伤等刺激,分别通过MEKK1→MKK4/MKK7→JNK/SAPK或MEKKs/TAK→MKK6/3→P38MAPK,激活核内的转录因子,进而诱导保护性蛋白的生成,增强细胞对应激原的抵抗力,或介导细胞凋亡。新近发现的MAPKs家族的第四种成员,即分裂原激活的大分子蛋白激酶(BMK1/ERK5),可能也参与调控应激情况下细胞的反应,但对其上游激酶及下游底物成分尚无确切的认识。
3.ROS作用的靶分子
尽管ROS参与细胞增殖、分化和凋亡相关的多条信号通路的调控,但ROS作用的确切部位尚未阐明,目前越来越多的证据显示,ROS可能通过改变氧化还原状态,调节信号转导通路中从细胞膜到细胞核不同水平多种信号转导分子的活性,完成其信使分子的功能。
(1)MAPKs级联反应
A.通过磷酸化/脱磷酸化调控
信号传递过程中,各级信号转导蛋白同时受到上游蛋白激酶和相应的磷酸酶的双重调节,其活性部位(主要是丝/苏氨酸或酪氨酸残基)可逆的磷酸化/脱磷酸化是传递信号的基础。
MAPKKK具有丝/苏氨酸蛋白激酶的活性,是信号传递过程中一类重要的激酶;相应的,细胞内也有一系列的丝/苏氨酸蛋白磷酸酶(PPs)对抗其磷酸化作用。如PPs中的PP2A的活化抑制ERK1/2及MEK1/2的活化,PP2C的活化抑制JNK及P38MAPK的活化。继续深入研究却发现H2O2对PP2C酶的活性无明显的抑制,却引起P38的活化,因此是否在信号通路中存在其他氧化还原敏感的PP酶有待进一步考察。
双特异激酶MAPKK及其上游蛋白激酶如胞膜的受体酪氨酸激酶(RTKs)和胞浆的Src家族、JAK家族等小分子都具有酪氨酸激酶(PTKs)的活性,同时细胞内也有一系列的蛋白酪氨酸磷酸酶(PTPs)对抗PTKs的磷酸化作用。越来越多的资料提示细胞内ROS水平增高或相对的氧化状态可引起PTKs的活性增强,但迄今为止尚无充足的证据表明ROS直接激活RTKs和PTKs等激酶,因为用H2O2直接作用于PTKs并不能增加其酶活性,却迅速引起PTPs的失活,予以GSH或其他巯基类还原剂后PTPs的活性恢复,而小剂量的H2O2抑制PTPs后PTK的活性增强,因此认为,ROS通过抑制PTPs的活性间接激活PTKs(图2)。已经发现,所有PTPs的催化活性部位都含有一个保守的cys(C124),胞外刺激信号引起的细胞内ROS水平增高,可直接氧化或通过氧化型GSSG间接氧化cys上的-SH(cys-SH),分别形成-SOH或-SSG,造成PTPs失活。
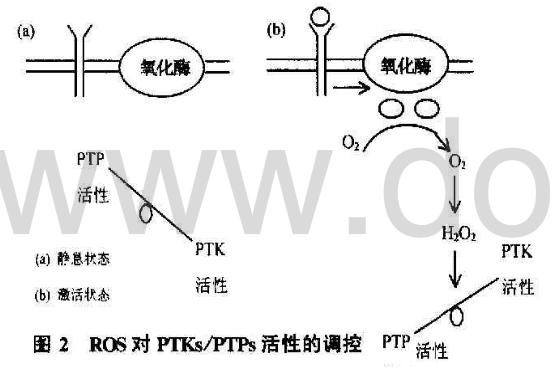
B.通过氧化还原敏感元件调控
ASK1是JNK和P38通路中MKK3/6、MKK4/7的上游蛋白激酶(MAPKKK),在生理情况下,细胞浆处于相对还原的状态,此时Trx与ASK1氨基端结合并抑制其激酶的活性。氧化应激或TNF等引起的胞内ROS增高,可通过两种机制调节ASK1的活性:一方面ROS引起Trx的二聚化并与ASK1分离,另一方面ROS可直接催化ASK1的cys-SH氧化,两分子ASK1通过分子间二硫键形成同源二聚体,酶的活性恢复,激活下游MAPKK,凋亡信号得以继续传递。
同样JNK的氧化激活也受到类似的调节,正常情况下,细胞内富含cys的氧化还原敏感元件GSTp与JNK结合并抑制后者的磷酸化,紫外照射或低浓度H2O2的刺激下,GSTp寡聚化并与JNK分离,JNK的活性得到恢复。
C.通过Ca2+调控
同为第二信使,Ca2+与ROS之间的关系越来越受到人们的关注。目前大量的资料提示ROS可能通过直接影响胞内Ca2+浓度的变化调节下游基因的激活或转录下调。
(2)转录因子的氧化还原调节
转录因子中许多为氧化还原敏感的,即它们的活性受细胞氧还状态的调控,这些氧化还原敏感的转录因子如NF-kβ、AP-1、P53等都含有保守的cys,人们猜测活性cys的巯基开关可能直接调节基因的表达。
NF-κB是很早发现的与细胞氧化还原状态密切相关的转录因子,通过调节多种蛋白的表达,参与细胞增殖、分化、凋亡、炎症及免疫等多种生物学效应。静息状态下,NF-κB由P65、P50和抑制亚基I-κB组成,定位于胞浆,在外来信号的作用下,I-κB磷酸化,并被遍在蛋白辍合酶降解,NF-κB活化入核,并与特异的DNA结合,调节其表达。研究发现,胞浆中抑制亚基I-κB的降解是NF-κB活化的关键,而入核后NF-κB与DNA的特异结合则是调节基因表达的决定性因素。胞内ROS增高或细胞处于相对氧化的状态,一方面通过增强遍在蛋白辍合酶的活性,促进I-κB的降解;另一方面却通过氧化P50亚基cys抑制NF-κB与DNA的结合。如dithiothreitol预处理抑制TPA引起的NF-κB的活化,应用谷胱甘肽还原酶抑制剂GR后,这一效应被部分逆转,相反在TPA处理1小时后加入dithiothreitol,NF-κB的活化效应得到增强提示NF-κB激活过程中从胞浆易位至胞核存在氧化型向还原型的转变,且P50亚基还原型cys62是NF-κB与DNA有效结合的重要保证,这就产生了一个矛盾,即转录因子的激活需要氧化状态的存在而转录因子与DNA的结合则需保持还原状态。
目前认为,Trx和GSH参与调节NF-κB在胞浆与胞核不同的氧化还原状态,主要依据是:
(1)含有活性cys的Trx表面具有靴状中空结构,可特异识别NF-κB P50亚基DNA结合域的loop结构,并作为质子供体促进氧化型cys的还原。
(2)氧化应激可促使Trx由胞浆易位入核。
(3)共转染hTrx与LTR-driven报告基团,依赖于NF-κB的报告基团表达增多。
同样,氧化应激或胞内GSSG增高引起转录因子AP-1的活化,但抑制其与DNA的结合。与NF-κB不同,Trx不能直接作用于AP-1,但可通过对另—种核蛋白Ref-1的氧化还原调节增强AP-1与DNA的结合能力。其他含cys的转录因子如P53、肾上腺皮质激素受体也受到类似的调节。
由HIF-1α和HIF-1β组成的异源二聚体——缺氧化还原调节的转录因子,HIF-1的活性取决于对氧高度敏感的HIF-1α的稳定性。研究发现,ROS对HIF-1α的调节依赖于其蛋白结构中的ODD域,正常生理条件下产生的H2O2足以引起遍在蛋白酶的磷酸化和HIF-1α降解,而缺氧时这一氧化还原敏感的蛋白降解途径被抑制,大量HIF-1α与HIF-1β结合形成稳定的二聚体,并易位入核,调节有关基因的表达,如促红细胞生成素、血管内皮生长因子和血管紧张素(ANG)等的表达,这在低氧条件下机体代偿性的增加血供,维持细胞正常的生理功能具有重要意义。
4.胞外刺激引起的胞内ROS产生部位、有关的信号通路以及相应的生物学效应(见表1,图3)


四、结束语
ROS,尤其是H2O2作为细胞的信使分子,对于细胞增殖分化凋亡的调控、胚胎的正常生长发育和机体稳态的调节具有重要意义。ROS的来源、ROS的作用机制、ROS对不同类型细胞作用的专一性以及ROS如何调节细胞的生死平衡将为近期研究的焦点,进一步的基础研究也将对认识ROS的生理病理功能和指导临床相关疾病的有效防治提供新的思路。