引言
现代生物物理学研究的一个重要目标就是阐述生物分子和它们聚集体的结构、组织及功能之间的联系。自从1972年S.Single和G.Nicolson提出膜的流动镶嵌模型以来,生物膜的研究有了飞速的发展,大量的科学家进入这一领域,推动了膜生物学的发展。流动镶嵌模型是人们理解膜结构和功能的经典理论基础,它强调了膜的流动性和膜蛋白质在膜脂中分布的不对称性,但是随着对膜结构与功能研究的深入,人们发现膜脂的分布也是不对称和不均一的。不同膜微区具有不同膜脂与蛋白质组成,因而具有不同的理化性质及生物学功能。实际上生物膜是一个由许多不同微区组成的微观上相对独立而宏观上联系的对立统一体系,正是这种特殊的膜体系才能使膜具有复杂而多变的功能。早在1977年,Jain和White就提出了生物膜结构的微区(Microdomain or lipid domains)模型,指出生物膜是由处于动态的微区(domains)组成(实验已证实),这一模型强调了质膜的流动镶嵌模型的镶嵌块特征。进一步研究发现,在这些富含鞘脂类和胆固醇的微区(现称为脂筏)具有独特的物理化学特性,即其形成的液态有序相漂浮于甘油磷脂的流体海洋中,在生物生理过程中发挥着重要的作用。

1992年Brown和Rose通过周密详实的实验提出了脂筏(lipid rafts)的假设,旨在说明这类脂锚定蛋白和信号激酶可以进出的特殊微区,而且脂筏已被证实是由大小为10~100nm的膜片(membranepatches)组成,且可以作为中介将与它相互作用的细胞蛋白和外周蛋白输送到细胞表面。近几年来新发展起来的实验手段,如扫描探针显微镜(SPM)等已经可以观察到生物膜纳米尺度上的结构和动态特性,从而使在分子水平上阐述生物膜微结构和功能的物理化学机制成为可能。
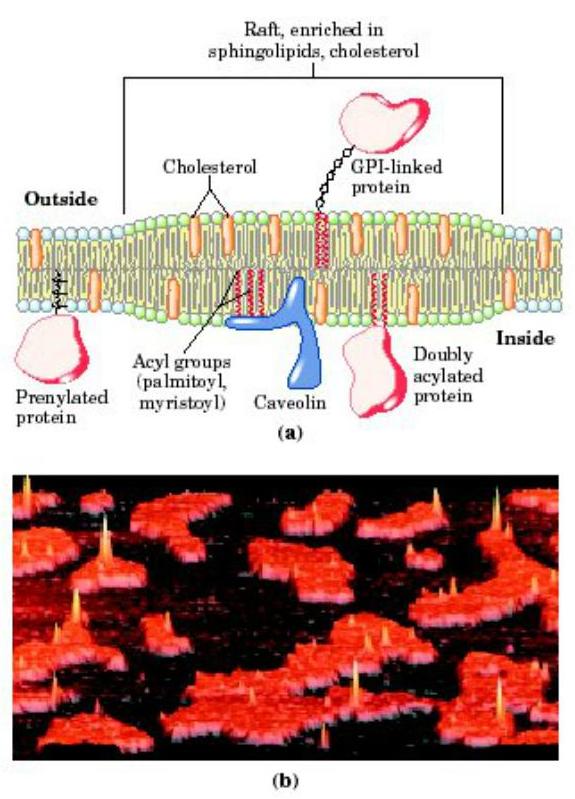
脂筏
脂筏是指膜脂双层内具有富含胆固醇和鞘脂(鞘磷脂和鞘糖脂)及蛋白质的微区,微区内陷可形成囊泡。这些具有一定功能的结构漂浮于二维流动的细胞质膜中,被人们形象地称之为“功能筏”。脂筏的组分和结构特点有利于蛋白质之间相互作用和构象转化,脂筏区主要参与信号转导和细胞蛋白转运。近年发现脂筏不仅存于质膜,亦可在高尔基体膜上。
脂筏的概念早在发现小窝时即有了,经长期的争论,直至1988年Simon才正式提出“脂筏”之称。
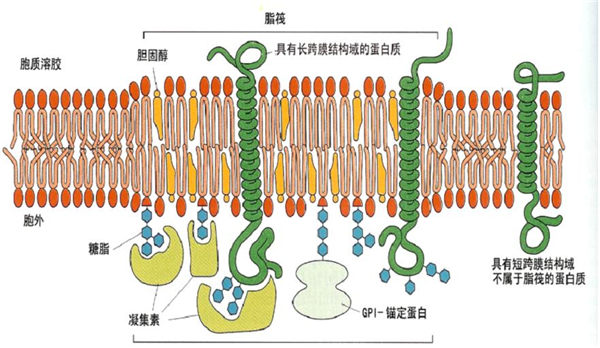
脂质的双层有不同的脂筏:外层的微区主要含有鞘脂、胆固醇及GPI-锚固蛋白,因为鞘脂含有长链饱和脂肪酸,Tm温度较高,流动性差,而且粘稠,邻近的磷脂区其脂肪酸多不饱和,Tm温度较低,所以出现分相;膜内侧也有相似的微区,与外侧的脂质不完全相同,主要是在此区有许多酰化的蛋白质,特别是信号转导蛋白。虽然两层分别有脂筏,但它们是偶联的,因为用非离子去污剂提取时,不仅有外层的GPI-锚固蛋白,还有许多信息分子共同被提出。用一种GPI-锚固蛋白的抗体介导锚固蛋白聚集,与此同时Src家族的酪氨酸激酶也被激活。如换成糖鞘脂的抗体,也有同样的现象。GPI蛋白及糖鞘脂都存于膜外侧,Src酪氨酸激酶在膜内侧,这表明脂筏内外层之间是有联系的。
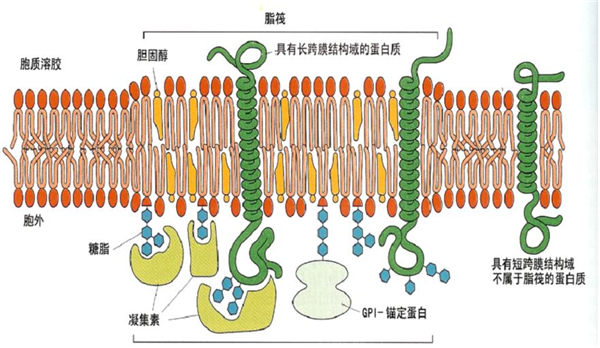
用不同的去污剂或改变溶解时的温度,所得到的脂质及蛋白质都有差异,说明细胞膜上的脂筏并不都等同。脂筏可能有三类:小窝、富含糖鞘脂膜区(Slycosphingolipid enrich membrane)、富含多磷酸肌醇(PIP2)膜区。不同的脂筏有其各自的特异蛋白,并有不同的功能。
脂筏内的蛋白质,有的是经跨膜直接插入膜,但更多的蛋白质需酰化,由酰化后的脂肪酸插入膜。Zacharias的实验表明,用水母蛋白的两个变异体,分别融合蓝荧光蛋白(CFP)及绿荧光(YEP)蛋白,然后在多肽链上分别联接脂化(棕榈酸、豆蔻酸、异戊二烯)的特异共同序列,用荧光能量共振转移(fluorescence resonanceenergy transfer)测定邻近效应,发现棕榈酰化及豆蔻酰化的蛋白质在脂筏的小窝区,而异戊二烯化的蛋白质形成二聚体,不在小窝区,对胆固醇不敏感,可能是另一类的脂筏。说明不同的酰化蛋白插入不同的脂筏。
脂筏的主要功能
近年来的研究表明,脂筏(包括质膜微囊)具有如下主要的功能:
①信号转导。从脂筏所含有的蛋白质和脂类来看,其中很多都是与细胞信号转导有关的组分,为信号的起始和交叉作用提供了一个结构平台。
②跨细胞运输。包括内吞和外排,同时也包括胞外毒素、细菌以及病毒的内吞。
③胆固醇的运送。
④维持胞内Ca2+的稳态平衡。
众所周知,物质通过细胞膜的内吞或外排或分泌都是以微囊形式来运送的。大量试验结果表明,这些微囊表面富含脂筏结构。同时脂筏是多种病原体进入宿主细胞的位点,支持病毒粒子的组装和出芽,其信号转导功能一方面可以启动宿主细胞的保护性免疫应答,另一方面也被病原体利用,以利于病原体的传播和疾病发生。此外,脂筏在朊蛋白感染、HCV基因组复制、多种细菌毒素作用以及维持疟原虫的胞内寄生生活等方面也都有重要作用。
据估计脂筏的面积可能占膜表面积的一半以上。脂筏的大小是可以调节的,小的独立脂筏可能在保持信号蛋白呈关闭状态方面具有重要作用,当必要时,这些小的脂筏聚集成大一个大的平台,在那里信号分子(如受体)将和它们的配件相遇,启动信号传递途径。
脂筏生物物理特性
Meer于2002年在《Science》上综述了此专题:脂筏是膜脂双层内含有特殊脂质及蛋白质的一种液态有序相微区。在生物物理方面,比较关心这种微区的相行为、结构、大小、分子成分、动力学以及脂类之间的相互作用等问题。根据温度等因素的影响,膜脂一般具有液晶(liquid disordered phase)和凝胶相(gel phase),而脂筏由于主要含有鞘脂与胆固醇,因而呈现介于液晶相与凝胶相之间的Lo相或称liquid ordered phase。换言之,脂筏中的脂质分子既是有序的又呈现液相,这是由鞘脂分子本身结构以及与胆固醇相互作用的结果。鞘磷脂的两条疏水链大多较长且高度饱和,这使得它们能够充分伸直而紧密排布,这也是脂筏组装体的一个重要特征。鞘脂类和磷脂不同的排布能力可能正是他们的混合膜发生相分离的关键因素。因此,富含鞘磷脂的脂筏与大家熟悉的疏松无序排布的磷脂区是共存的。处于不同相态(大多是液态凝聚相和类固态的凝胶相)的脂类之间发生的相分离已得到了广泛的研究。众所周知,在纯的磷脂双层中加入胆固醇,可使正常的胶态和液态凝聚相之间明显的热转变相消失,这表明了在高浓度胆固醇环境下,含有不同种类磷脂的脂质体会形成不同组分相分离的微区,已为大家理解和接受。有序态和无序态不能共存。进一步研究表明,在胆固醇和两种磷脂的混合体系中可发生一种不同的相分离行为:类液晶相区和一种新的液态有序相区共存,在这种新的液态有序相中,脂类的脂肪酰链充分伸直并密集排布和胶态类似,但有高度的侧向流动性。脂筏可能存在于这种液态有序相或者具有与之类似的相态中。因此可以说脂筏以液态有序相存在。这些研究结果证实,在含有两种磷脂(或其中一种是鞘磷脂)与胆固醇的三项混合体系(它们具有不同的熔点)中,可以发生两个并列的液态有序相/液晶相和胶态相/液晶相的相分离:磷脂/鞘脂类混合体系既可在没有胆固醇存在的情况下发生胶态和液晶态之间的相分离,也可以在胆固醇存在的情况下发生液态有序相和液晶相之间的相分离。胆固醇可以促使相分离行为的发生。因此,胆固醇存在条件下形成液态有序相所需要的鞘脂类含量,比没有胆固醇情况下形成胶态需要的鞘脂类量少,在鞘脂类含量相对较少的细胞膜中形成脂筏,胆固醇的耗尽导致脂筏的破裂而影响脂筏的功能,这也可以解释相变温度处于37~41℃的神经鞘磷脂,可以和具有较高熔点的鞘甘脂一样有效地促使脂筏的形成,但其稳定性没有胆固醇形成的脂筏好。究其原因,可能是饱和脂类与胆固醇之间的相互作用。另外,SpM有更多的官能团参与在极性头基区形成氢键,然而氢键对胆固醇和SpM相互作用到底有多大的贡献,目前仍不清楚。由于类脂的头基也是调节类脂排布结构的一个重要因素,因此它们对脂筏的形成起着重要的作用。比如,磷脂酰乙醇胺,头基很小,和对应的磷脂酰胆碱相比,具有较高的熔点温度,这种作用可能在鞘脂类含量较少而磷脂酰乙醇胺较多的脂双层内叶中更为重要。
从结构及组分分析,脂筏有两个特点:
①许多蛋白质聚集在脂筏内,便于相互作用。
②脂筏的环境有利于蛋白质的变构,形成有效的构象。
在细胞中脂筏更重要的作用就是它在信号转导事件中所发挥的功能。目前已研究发现,有多种类型的信号分子与脂筏相关,如受体分子类、离子通道和泵相关分子、蛋白激酶、GTP结合蛋白、配体蛋白、钙离子结合蛋白、黏附分子、细胞骨架相关蛋白质类、转录因子和脂类等。脂筏是如何积聚这些信号分子并激发细胞内信号转导的级联反应是值得深入探讨的问题。脂筏调节细胞信号转导的两个主要模式;在简单的模式中,脂筏作为一个募集特定信号分子的平台,有助于信号分子之间的相互作用和下游信号转导事件的发生。在此模式中,受体、偶合因子、效应酶和底物共定位于同一个脂筏区域。由于各个信号分子之间的空间结构彼此相邻,细胞信号转导事件能快速有效的发生。通过将受体分子严格定位到含有一组特定信号元件的脂筏区域,能提高信号转导事件发生的特异性。这种严格定位将限制受体与其他信号通路上分子的相互作用,阻止非特异性信号的发生。而且,脂筏本身空间积聚的能力也证实了脂筏能募集参与信号转导的一组特定的信号分子,从而特异地激发细胞的信号转导。在更为复杂的模式中,起初信号转导通路上相互作用的各信号分子分散在不同脂筏区域;激素或生长因子的刺激导致了脂筏微区瞬间融合。当正常定位于质膜非脂筏微区的受体或其他特定的分子积聚到脂筏微区时,脂筏将含有能被激活的完整信号转导通路上几乎所有的信号分子。脂筏微区将不同的信号分子积聚在同一区域,促进了它们之间的相互作用和信号转导通路的激活。在这个模式中,脂筏微区通过区域化信号分子来调节信号转导的发生。存在于不同生理条件下的信号分子的积聚,严格限定了在特定信号转导通路上各信号分子之间的流动;但信号通路所介导的生物学功能,并非特异地需要信号蛋白募集于脂筏微区;而由脂筏介导的原本相互作用的蛋白质之间的分离,也可能导致某些信号通路的失调节。通过分析分离出来的各种细胞的脂筏及小窝中的蛋白质,发现许多信号分子富集在脂筏和小窝中。
附录:关于脂筏的国际规范定义
2006年3月23~28日,在美国康州汽艇泉港(Steamboat Spring)组织召开了“脂筏与细胞功能”的基本原理专题讨论会。世界生物物理、生物化学和细胞生物学领域的学者共聚一堂,讨论了脂筏的结构和功能。在会上主要探讨了五个问题:
1.决定弃用“脂筏”而优选“膜筏”一词。虽然公认脂类的相分离(phase separation)可为膜域的形成提供基本的能量驱动,但膜筏的形成“只决定于脂类驱动的相互作用”这一概念已被“蛋白质和脂类两者均与膜微域生成有关”的观点所取代。
2.膜筏不仅见于质膜,细胞内膜如内质网与线粒体上也含有筏样域。
3.虽然富集胆固醇与鞘脂己成为膜筏的特征,但维奇(Veatch)等学者认为,在缺乏高浓度Ch的条件下也可能生成膜筏。
4.介绍用于膜筏研究的成像和分析方法,如电镜的单独应用及同空间统计的联合使用,异源荧光与同系荧光共振能量转移,荧光猝灭,荧光衰期成像显微镜检查,光漂白后的荧光恢复,荧光相关光谱分析,光栅扫描成像相关光谱分析及单粒跟踪等。
5.膜筏的非均一性不仅呈现在三维空间,而且伸展到第四维,即时间范畴。筏可能短暂出现或呈相对稳定,但皆可视为动态的结构。通过蛋白质一蛋白质相互作用,几个小型筏可聚集以生成稳定的重要生物学结构,如免疫突触或全刷缘膜(entire brush border membrane)即为其特殊示例。
会议集思广益,之后达成一致意见,提出膜筏定义:膜筏是一种非均一性富集固醇和鞘脂的高动态小型域,约10~200nm大小。它能使细胞过程隔室化。有时小型筏会借助蛋白质-蛋白质以及蛋白质-脂类的相互作用,稳定地形成较大平台。此定义将有助于澄清因筏的非均一性和短暂性而困扰近期该领域的理念纷纭。为与国际公认的提法接轨,建议我国生化名词采纳膜筏的此规范定义。