刘垒冯杜朱玉山陈佺
《中国细胞生物学学报》2012年10期
【作者单位】:中国科学院动物研究所;南开大学生命科学学院
【摘要】:
线粒体自噬(mitophagy)是指细胞通过自噬的机制选择性地清除线粒体的过程。选择性清除受损伤或功能不完整的线粒体对于整个线粒体网络的功能完整性和细胞生存来说十分关键。线粒体自噬的异常和很多疾病密切相关,因此对于线粒体自噬的具体分子机制以及生理意义研究有很重要的生物学意义。线粒体自噬的研究是目前生物学领域的研究热点,该文主要综述了近年来在线粒体自噬领域取得的研究进展,旨在为相关领域的研究提供参考。
1线粒体自噬的概述
线粒体决定细胞的生存和死亡。一方面,线粒体是细胞的能量工厂,通过氧化磷酸化为细胞的生存提供能量和生物合成的底物;另一方面,线粒体代谢过程中活性氧的异常积累会引起线粒体损伤,从而释放促凋亡蛋白,如细胞色素C和其它凋亡因子等。细胞色素C释放能引起凋亡蛋白复合体(apoptosome)的形成和Caspase-9的激活,并通过一系列级联放大反应来活化下游的Caspase家族蛋白,启动细胞的凋亡过程。
为维持细胞的正常活动状态,受损伤或不需要的线粒体需被及时清除掉。新的研究表明,细胞主要通过自噬机制选择性地清除受损伤或不需要的线粒体,这一过程被称为线粒体自噬(mitochondrial autophagy或mitophagy)。早在1962年就有文献报道,体外灌注的大鼠肝脏用胰高血糖素处理15min后,通过电镜观察发现了很多被膜结构包裹的线粒体,并且这些线粒体随后会被溶酶体降解掉。但线粒体自噬这一概念由Lemasters于2005年正式提出。他观察到线粒体膜电位降低和线粒体通透性膜孔开放能引起线粒体自噬,并认为线粒体自噬可能在减少由衰老引起的线粒体DNA突变中起着重要的作用。越来越多的研究表明线粒体的清除是一个选择性的过程,线粒体自噬的研究是目前细胞生物学和线粒体研究领域的热点课题。线粒体自噬的异常与多种疾病包括神经退行性疾病、血液病和心血管疾病甚至癌症的发生有密切关系。研究线粒体自噬的分子调控机制将有助于了解这些疾病的发生机制和寻找新的疾病预防及治疗的策略。
2线粒体选择性自噬的机制
2.1酵母中线粒体自噬的调控机制
自噬主要的生理功能是能够将胞质中的大分子物质和一些损坏的细胞器通过溶酶体途径降解,实现能量的再循环,以维持细胞自身的稳定。自噬分为三种类型,分别是大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导的自噬(chaperonemediated autophagy,CMA)。目前研究尤其充分的是大自噬,大自噬是指长寿命蛋白或细胞器被双层膜结构的自噬小泡包裹起来,并且和溶酶体发生融合并降解的过程。自噬的早期研究主要是利用酵母开展的,前期的研究工作鉴定出了一系列参与自噬过程的蛋白质,这些蛋白都被命名为Atg(autophagy-related gene)家族蛋白。目前为止已经发现了36种Atg家族蛋白,这些蛋白在自噬的不同阶段发挥着重要的作用。其中Atg6通过和VPS34形成复合物参与了自噬的起始阶段。自噬体的延伸需要两个蛋白结合系统,这两个系统各含有一个泛素类似的蛋白Atg12或Atg8。Atg12能够和Atg5及Atg16形成一个大的复合物,而Atg8能够在Atg4、Atg3和Atg7的帮助下和一个膜脂成分磷脂酰乙醇胺(PE)结合,两者都参与了自噬小泡的延伸。在饥饿的情况下,酵母也会发生典型的线粒体自噬。酵母中可以很方便地进行大规模的筛选实验,因此,酵母线粒体自噬的调控机制研究取得了很多进展。Uth1p是很早发现的调控酵母线粒体自噬的一个蛋白,它是一个线粒体外膜蛋白,Uth1p基因的缺失能够抑制由饥饿或者雷帕霉素引起的酵母线粒体蛋白的降解,提示这个蛋白在线粒体选择性清除中起着关键的作用。随后又发现另一个位于线粒体膜间隙的蛋白Aup1p也参与了酵母的线粒体自噬,Aup1p是一种磷酸酶,它参与了酵母细胞生长平台期发生的线粒体自噬的调控。
近期Klionsky和Ohsumi实验室同时鉴定出了一个参与酵母线粒体自噬调控的新蛋白,这个蛋白被命名为Atg32。Atg32是一个线粒体外膜蛋白,其N末端定位于胞浆,C末端位于线粒体膜间隙。在非发酵的甘油培养基中培养时,当酵母进入对数生长后期后,就会发生线粒体自噬从而降解掉一部分线粒体,而Atg32缺失的酵母能够几乎完全抑制这种线粒体自噬的产生。Atg32的缺失并不会影响饥饿引起的自噬水平,只是特异地参与了线粒体自噬的调控。在线粒体自噬被诱导后,Atg32能够和参与细胞自噬的关键蛋白Atg11相互作用。在Atg32的胞浆区域还具有典型的Atg8结合区域即LC3相互作用区域(LC3 interacting region,LIR),通过实验证实Atg32和Atg8有直接的相互作用,Atg32可能通过和隔离膜(isolation membrane)上的Atg8及Atg11的相互作用,使得线粒体逐渐被自噬小泡包裹从而被降解掉,并且Atg32和Atg11的相互作用受到了Atg32的114位丝氨酸磷酸化的调节,蛋白激酶Hog1和Pbs2通过调控未知的蛋白激酶对Atg32的磷酸化能够促进Atg32和Atg11的相互作用和线粒体自噬的发生。
Atg32在哺乳动物里没有同源蛋白,这说明哺乳动物里还有其他的基因参与了线粒体自噬的调控,下面将主要介绍参与哺乳动物线粒体自噬调控的蛋白。
2.2 Parkin依赖的线粒体自噬的调控
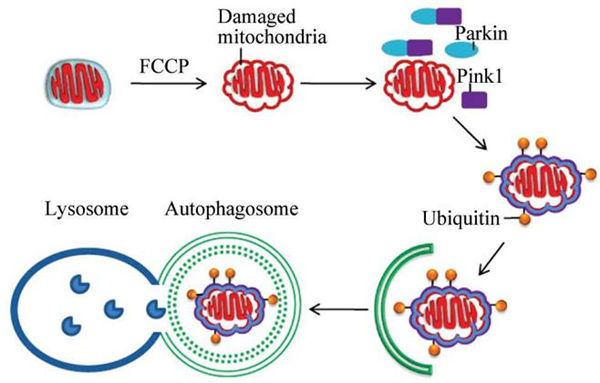
线粒体膜电位的降低可能导致线粒体自噬。体外培养的肝细胞在饥饿的情况下能观察到快速的线粒体被降解的情况,而用线粒体MPT孔的抑制剂CsA能够在抑制膜电位降低的同时抑制线粒体自噬的发生。近期的研究表明,Parkin和Pink1蛋白参与了膜电位降低引起的线粒体自噬的发生。
Parkin是一个E3泛素连接酶,Pink1是一个丝氨酸/苏氨酸激酶,位于Parkin的上游发挥作用。Pink1能磷酸化Parkin,促进Parkin由胞浆到线粒体的转位,Parkin和Pink1功能丧失的点突变和帕金森综合征的发生有密切的关系。
美国Richard Youle实验室研究发现,Parkin能被选择性地募集到膜电位降低的线粒体,并且介导线粒体被自噬体包裹。Pink1和Parkin有相互作用,Pink1在损伤的线粒体上的积累能为Parkin选择性降解线粒体提供信号(图1)。Parkin被募集到线粒体上后能通过介导VDAC1的泛素化参与线粒体的自噬,在这个过程中p62也被募集到线粒体上,启动了线粒体自噬。但也有文章表明,p62只参与了Parkin介导的线粒体聚集而与线粒体自噬没有关系,而VDAC1在线粒体自噬中的作用尚有争论。Parkin和Pink1还能通过协同降解Miro蛋白影响线粒体运动,从而在损伤的线粒体被降解之前先阻滞了其运动,而在损伤的线粒体上Pink1和TOM复合体形成一个700kDa左右的复合物,参与了Parkin介导的线粒体自噬的调控。同时果蝇里的研究表明,Parkin和Pink1能介导和线粒体融合有关的蛋白Mfn的泛素化,Parkin或Pink1缺失的情况下,Mfn的蛋白量增加,从而促进了线粒体的融合,而Mfn的泛素化也可能是线粒体自噬的信号,泛素化的Mfn被清除后,线粒体的融合功能丧失,随后会通过自噬被降解掉。而在哺乳动物中的研究发现,线粒体分裂有关的蛋白Drp1是Parkin的底物,敲减Parkin后会引起线粒体的破碎。关于Pink1在线粒体自噬中的作用,也有相反的报道,在SH-SY5Y细胞里面敲减Pink1后能引起线粒体的片段化,而高表达Pink1能增加线粒体的融合程度并抑制药物引起的线粒体自噬。所以,关于Parkin和Pink1在线粒体动态变化以及损伤的线粒体被选择性清除的过程中所扮演的角色和具体机制仍有待更深入的研究。

2.3缺氧介导的线粒体自噬的调控
我们新的研究表明,线粒体外膜蛋白FUNDC1参与了缺氧介导的线粒体自噬。FUNDC1是一个三次跨膜蛋白,定位在线粒体外膜上,在FUNDC1高表达的情况下能够引起明显的线粒体自噬,并且FUNDC1引起的线粒体自噬是Atg5依赖的。FUNDC1存在保守的LIR结构域,并且依赖LIR和自噬的关键分子LC3相互作用,来介导低氧诱导的线粒体自噬。LIR保守结构域的突变或缺失能够抑制其与LC3的相互作用和线粒体自噬。FUNDC1高表达引起的线粒体自噬在Atg5敲减的细胞里受到了明显的抑制,而Beclin1的敲减并不能抑制FUNDC1引起的线粒体自噬,提示FUNDC1引起的线粒体自噬和文献报道的神经毒性药物MPP(+)引起的线粒体自噬一样,都是Beclin1非依赖的。进一步的机制研究表明,FUNDC1的磷酸化在线粒体自噬调控中发挥了关键作用。在正常情况下,FUNDC1能被蛋白激酶Src磷酸化,而磷酸化的FUNDC1和LC3的相互作用比较弱,FUNDC1的功能受到抑制。在低氧情况下,蛋白激酶Src的活性降低,导致FUNDC1磷酸化水平的降低,从而促进其与LC3相互作用和线粒体自噬的发生。
像Atg32一样,FUNDC1介导的线粒体自噬也受到磷酸化调控,这进一步说明了线粒体自噬机制在进化上的保守性(图2)。FUNDC1作为新的线粒体自噬受体的发现使我们有机会进一步研究哺乳动物细胞线粒体自噬的调控机制。有必要进一步分析FUNDC1介导的线粒体自噬与Parkin介导的线粒体自噬的相互关系及FUNDC1的生理功能及其与疾病发生的关系。


2.4 Bnip3/Nix介导的线粒体自噬
Bnip3蛋白及其同源蛋白Bnip1和Bnip2起初是利用腺病毒的E1B 19kDa蛋白做诱饵通过酵母双杂交鉴定出来的,这些蛋白能和E1B 19kDa蛋白以及Bcl2蛋白相互作用。随后一系列的文章证明了Bnip3具有诱导细胞死亡的作用。Bnip3能形成稳定的二聚体,并且C端的跨膜区对于其在线粒体的定位是必需的,高表达Bnip3能诱导大鼠的成纤维细胞和MCF-7细胞的凋亡,而Bn中3跨膜区缺失的突变体不能诱导凋亡。Bn中3除了在细胞死亡中发挥着重要的作用,同时它也是细胞自噬乃至线粒体自噬过程中的重要参与者。胶质瘤用Ceramide或Arsenictrioxide处理后会出现典型的自噬性细胞死亡,Bnip3在这种情况下的表达量有明显的升高,而且肿瘤细胞直接转染Bnip3能出现很明显的自噬现象。在缺血再灌注模型中,Bnip3功能缺失的突变体能够起到保护作用,而用Atg5 K130R抑制自噬会使细胞死亡增加。所以,Bnip3在缺血再灌注损伤的情况下会激活自噬反应,后者清除损伤的线粒体,可能会起到一种保护作用。近期的研究表明,Bnip3和自噬的关键蛋白LC3有直接的相互作用,介导了线粒体自噬的发生。
红细胞成熟的过程中需要有线粒体等细胞器的选择性清除,因此红细胞的成熟过程为线粒体自噬提供了一个很好的研究模型。Nix和Bnip3在蛋白序列上有56%的同源性,并且在人的各个组织里广泛表达,而且在肿瘤细胞里高表达Nix能明显抑制细胞的增殖。Nix的表达量在红细胞分化成熟中显著上调,这可能和Nix在红细胞成熟过程线粒体通过自噬被清除的过程中扮演着重要的角色有关系。Nix敲除的小鼠存在成熟红细胞的减少和幼稚粒细胞的增加,而且这种小鼠红细胞里面的线粒体仍然存在,说明在Nix缺失的情况下红细胞成熟过程中线粒体的清除发生了障碍。Nix被诱导后通过某些未知的原因引起线粒体膜电位下降,从而激活自噬机制,引起线粒体被选择性地清除。进一步的研究表明,Nix可能是一个线粒体自噬的直接受体,它能够和LC3蛋白直接结合,并募集LC3到损伤的线粒体上引起线粒体自噬的发生。
Ulk1是酵母Atg1基因在哺乳动物中的同源蛋白。新的研究表明,Ulk1作为一个丝氨酸/苏氨酸蛋白激酶,在红细胞成熟过程中对线粒体的选择性清除发挥着重要的作用。在Ulk1基因敲除的小鼠血液里未成熟的网织红细胞明显增加,并且出现一种和网织红细胞一样有线粒体存在的CD71阴性的红细胞,而且在体外培养的条件下,Ulk1基因缺失的网织红细胞的线粒体的清除有所减缓。但是,Ulk1的缺失并不能抑制饥饿引起的自噬的发生,表明Ulk1参与了红细胞成熟过程中线粒体选择性清除的过程。
另外一个自噬的关键蛋白Atg7也参与了红细胞发育过程中的线粒体自噬,在血液系统中特异地敲除和自噬有关的基因Atg7后,小鼠红细胞中线粒体的清除发生障碍,导致很多损伤的线粒体的堆积,引起红细胞死亡从而导致小鼠产生严重的贫血。
2.5线粒体融合分裂及相关蛋白和线粒体自噬的关系
一些研究也发现,和线粒体融合与分裂有关的蛋白质也参与到了线粒体自噬过程中。线粒体分裂后通常会产生两个不均匀的子代。其中部分线粒体能恢复膜电位,并能与其他线粒体发生融合,成为线粒体网络的一部分。有些线粒体膜电位不能恢复,膜电位下降的线粒体就会被选择性地通过自噬降解。高表达促进线粒体融合的蛋白OPA1能抑制线粒体自噬的发生。看来线粒体融合不仅能拮抗线粒体分裂,也能阻止线粒体自噬。这三者间存在一种动态平衡来调控线粒体质量。
Fis1也是一个和线粒体分裂有关的蛋白,它能与线粒体分裂有关的蛋白Drpl相互作用来促进线粒体的分裂。有研究表明,Fis1也可能参与了线粒体自噬的调节,高表达Fis1以及它的一个突变体都能够促进线粒体自噬的发生。
总之,在哺乳动物细胞里面有很多蛋白参与了线粒体的自噬,既有自噬过程中的关键分子如Ulk1和Atg7,也有与线粒体形态变化有关的蛋白Fis1和Parkin。与细胞死亡有关的蛋白Bnip3和Nix,以及参与了缺氧介导的线粒体自噬的FUNDC1都定位在线粒体上并且和自噬中的关键蛋白LC3有直接的相互作用,是介导线粒体自噬的关键受体蛋白(图3)。这些蛋白一起协同参与了线粒体自噬的发生,并且这些蛋白可能在线粒体自噬的不同阶段发挥着重要的调节作用。

3线粒体自噬的生理意义
3.1线粒体自噬的重要性
线粒体主要通过电子传递链产生ATP为机体提供生存所需的能量,但是在电子传递的过程中也有副产物活性氧(ROS)的出现,ROS包括过氧化物、羟自由基以及过氧化氢。ROS能攻击蛋白质、脂肪酸和核酸并且启动过氧化的连锁反应。因此,损伤的线粒体需要被及时地清除掉,否则其可能会对细胞造成更严重的危害。选择性的线粒体自噬在线粒体的清除中发挥着重要的作用。MPT孔的开放能够促进线粒体自噬的发生,MPT孔的抑制剂CsA能够阻止MPT线粒体的去极化,并且能抑制线粒体自噬的发生,在这种情况下损伤的线粒体能通过线粒体自噬被清除掉。
3.2线粒体自噬和衰老
线粒体自噬和细胞的衰老也有关系。线粒体是一个持续的ROS的来源地,这些ROS导致mtDNA的突变,线粒体DNA的修复能力不强,使得这些突变逐渐积累。线粒体DNA的突变可能削弱氧化磷酸化关键的蛋白的合成,会导致产能衰竭和细胞死亡。因此,通过线粒体自噬清除功能丧失的线粒体能够抑制细胞的衰老。随着机体的衰老,细胞的自噬机制也逐渐减弱,使损伤的线粒体逐渐堆积,会加剧衰老。
3.3线粒体自噬和红细胞及淋巴细胞发育
近期一系列的研究发现,几个与自噬有关的基因(Atg7、Ulk1)以及与细胞凋亡有关的基因(Nix)参与了红细胞成熟过程中线粒体的选择性清除过程。在这些基因敲除的小鼠中都存在红细胞成熟障碍,红细胞中线粒体的清除受到了影响,从而使得红细胞的功能也受到了抑制,导致了贫血或者其他的一些血液系统疾病。同样,线粒体自噬在T淋巴细胞的发育成熟过程中也起着重要的作用。在Atg7敲除的小鼠中,T淋巴细胞的线粒体清除发生障碍,从而使得细胞里的活性氧的产生增加,并且导致T淋巴细胞的功能障碍以及凋亡。
3.4线粒体自噬和神经系统疾病
线粒体自噬对于神经系统的发育和功能的维持也是很重要的。神经细胞依赖于自噬来控制蛋白的质量并且移除损伤的线粒体。在正常的情况下,线粒体自噬能起到保护神经细胞的作用,然而有时线粒体自噬的调节失常会导致神经退行性疾病。线粒体功能的丧失可能在帕金森症的发生中起着重要的作用,而Parkin对于维持线粒体的正常功能是很关键的。Parkin能够选择性地被募集到膜电位下降的线粒体上,从而介导线粒体的自噬,清除掉功能丧失的线粒体。而在帕金森症中经常存在着Parkin蛋白的突变而导致的功能丧失,Parkin的功能丧失会引起线粒体自噬的缺陷,从而导致帕金森症的发生。
在一种Purkinje细胞降解(Purkinje cell degeneration,PCD)小鼠中的研究发现,线粒体的过度自噬还和Purkinje细胞的逐渐消失有着密切的关系。这种小鼠有显著的神经共济失调,这种共济失调主要是由于99%的Purkinje细胞在小鼠出生后3周内就消失而造成的。这种小鼠的Purkinje细胞自噬明显被上调,从而选择性地降解线粒体,因为线粒体被过度地降解,使得Purkinje细胞发生能量崩溃,导致Purkinje细胞的死亡。然而在这种小鼠的Purkinje细胞里线粒体的形态是异常的,所以也有可能是因为其他原因导致了线粒体功能的异常,使得线粒体的自噬水平升高,所以线粒体自噬在这个病理过程中仍然是起到了保护作用。
总之,线粒体自噬是细胞一个十分重要的过程,线粒体自噬的存在对于调控细胞内环境的稳定十分必要。目前对线粒体自噬的研究刚刚起步,其中的分子机制远不清楚,而且线粒体自噬和机体发育生长以及疾病之间的关系仍然不是特别明了。我们新鉴定的线粒体自噬的受体将很大地推动线粒体自噬调控机制及线粒体质量控制在疾病发生中的作用的研究。